ペプチドグリカンが免疫制御細胞を誘導して腸炎を抑える仕組みを解明:医療技術ニュース
慶應義塾大学は、腸内の細菌叢を改善するプロバイオティクスであるクロストリジウム属細菌の菌体成分ペプチドグリカンが、免疫調節たんぱく質と免疫制御細胞を誘導し、腸炎を抑える仕組みを解明した。
慶應義塾大学は2015年7月1日、腸内の細菌叢を改善するプロバイオティクスであるクロストリジウム属細菌の菌体成分ペプチドグリカンが、免疫調節たんぱく質と免疫制御細胞を誘導し、腸炎を抑える仕組みを解明したと発表した。同大医学部微生物学の吉村昭彦教授、金井隆典教授らの研究によるもので、同年6月30日に米科学雑誌「Immunity」オンライン版で公開された。
人間の腸に生息する腸内細菌は、免疫のバランスを制御し、健康を維持する要因とされている。免疫系で炎症を抑える細胞としては、腸内に多く存在する制御性T細胞(Tレグ)があるが、腸内細菌の中でも特にクロストリジウム属細菌が腸管でTレグを誘導することが知られている。またTレグは、強力な抗炎症作用を持つトランスフォーミング増殖因子-β(TGF-β)というたんぱく質によって誘導されるが、TGF-βがどの細胞で作られ、Tレグ誘導をどう調節しているかは不明とされていた。
同研究グループでは、クロストリジウム・ブチリカムMIYAIRI588株(以下、クロストリジウム菌株)をマウスに投与すると、Tレグが増加して腸炎が抑制されることに着目。腸内細菌によるTGF-βとTレグの誘導のメカニズムを検討した。その結果、クロストリジウム菌株の主要な菌体成分であるペプチドグリカンが、免疫細胞の1種である樹状細胞を刺激してTGF-βの分泌を促進し、TGF-βによってTレグが誘導されて炎症を抑制するという仕組みが明らかにされた。
さらに、ペプチドグリカンによって誘導されたTGF-βは、ERK-AP-1(ERK:細胞外シグナル調節キナーゼ、AP-1:アクチベータータンパク質1)経路とTGF-β-Smad3経路の2つの経路によって産生誘導されていることが分かった。反対にSmad2が、染色体の構造を転写抑制型に変化させることで、TGF-βの産生を抑えるという負の調整をしていることも明らかになったという。
同研究で示されたTGF-βの分泌誘導、Tレグの誘導メカニズムは、今後、潰瘍性大腸炎やクローン病などの炎症性腸疾患やアレルギーに対して、効果的で安全性が高く、安価な治療法や予防法の開発につながるとしている。
関連記事
 「システムズエンジニアリング」の正しい理解がISO26262対応に役立つ
「システムズエンジニアリング」の正しい理解がISO26262対応に役立つ
慶應義塾大学大学院 システムデザイン・マネジメント(SDM)研究科 准教授の白坂成功氏は、宇宙機「こうのとり」のシステム設計に携わる中で学んだ「システムズエンジニアリング」を広めるべく大学で教べんをとっている。白坂氏に、宇宙機の安全設計や、ISO 26262などの機能安全規格のベースになっているシステムズエンジニアリングについて聞いた。 3Dプリンタとインターネットが掛け合わさる領域でこそ本当に面白いモノが生まれる
3Dプリンタとインターネットが掛け合わさる領域でこそ本当に面白いモノが生まれる
ローランド ディー. ジー. 主催イベント「monoFab Experience Day」の特別講演に登壇した慶應義塾大学 環境情報学部 准教授 田中浩也氏の講演から、教育における3Dプリンタの可能性、3Dプリンタとインターネットによる新しいモノづくりの在り方について紹介する。 3Dプリンタだけのモノづくりは、電子レンジだけで料理するようなもの
3Dプリンタだけのモノづくりは、電子レンジだけで料理するようなもの
Makerムーブメントの原点として高く評価され、再刊が望まれていた「ものづくり革命 パーソナル・ファブリケーションの夜明け」が、「Fab―パーソナルコンピュータからパーソナルファブリケーションへ」として再刊された。本書を監修したFabLab鎌倉の田中浩也氏にインタビュー。「3次元プリンタは電子レンジと似ている」ってどういうこと? 「やりたいこと」「やるべきこと」「やっていること」が一致する仕事に就け――SIM-Drive 清水浩名誉教授
「やりたいこと」「やるべきこと」「やっていること」が一致する仕事に就け――SIM-Drive 清水浩名誉教授
32歳の時に研究テーマを変えながらも、今や世界的に有名な研究者となった教授がいる。専門性にとらわれず「何でもあり」の発想で次々に画期的な技術を生み出してきた清水教授が没頭しているのは、電気自動車の研究。電気自動車を普及させることで、地球環境やエネルギーの問題を解決したいと真剣に考える清水教授に、理系のキャリアについて語っていただいた。 個人製造業時代に! 市民工房ネットワーク「FabLab」の世界代表者会議が横浜で開催
個人製造業時代に! 市民工房ネットワーク「FabLab」の世界代表者会議が横浜で開催
多様な工作機械を備え“市民モノづくり”を振興する実験的な市民工房ネットワーク「FabLab」の各国の代表者が集まる第9回世界会議が「FAB9」が2013年8月21日〜27日まで神奈川県横浜市で開催される。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
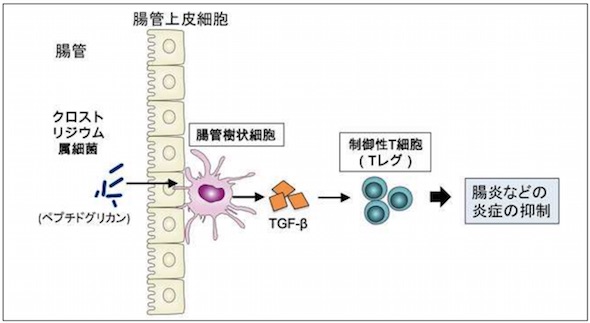 腸管においてクロストリジウム属細菌がTレグを誘導する流れ
腸管においてクロストリジウム属細菌がTレグを誘導する流れ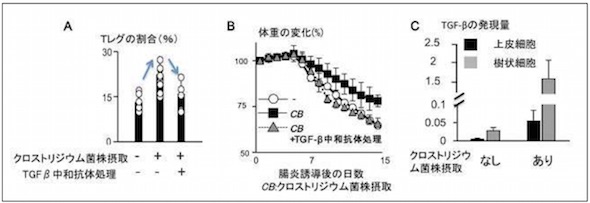 クロストリジウム菌株の経口投与でTGF-βの分泌が促進され、腸炎が改善する
クロストリジウム菌株の経口投与でTGF-βの分泌が促進され、腸炎が改善する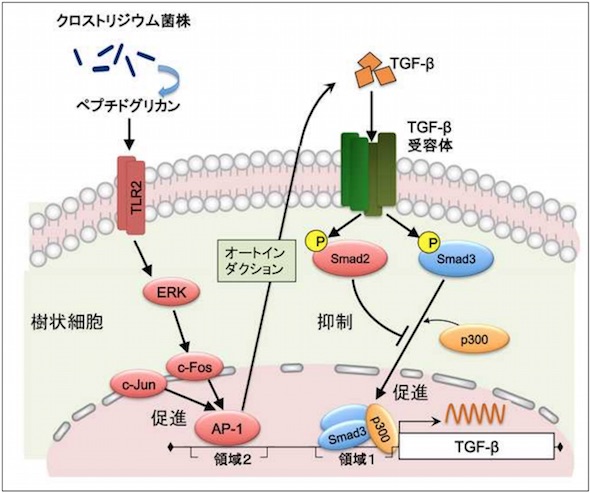 ペプチドグリカンによるTGF-β遺伝子の発現制御メカニズム
ペプチドグリカンによるTGF-β遺伝子の発現制御メカニズム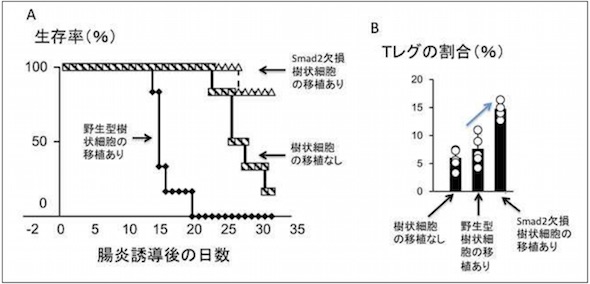 Smad2のない樹状細胞は実験的な腸炎を抑制し、Tレグを増加させる
Smad2のない樹状細胞は実験的な腸炎を抑制し、Tレグを増加させる


