分子ナノシステムを設計し、筋収縮時の分子の動きを捉えることに成功:医療技術ニュース
理化学研究所は、筋収縮の最小機能単位であるサルコメア構造の一部を人工的に設計し、筋収縮の瞬間におけるモーター分子の動態を直接的に捉えることに成功した。肥大型心筋症の要因となるミオシン変異体を分子レベルで詳細に診断可能になる。
理化学研究所は2019年11月27日、筋収縮の最小機能単位であるサルコメア構造の一部を人工的に設計し、筋収縮の原理を解明することに成功したと発表した。同研究所生命機能科学研究センター細胞動態計測研究チーム チームリーダーの柳田敏雄氏らによる研究成果だ。
肥大型心筋症の主な原因として、心臓を拍動させるモータータンパク質「ミオシンII」の変異が挙げられる。治療に応用するため、ミオシンの機能を正常な状態に戻す化合物の開発が望まれているが、これまでの手法ではミオシンの動きを直接捉えることができず、化合物開発に必要な収縮時のモーター分子の動態を調べるのは困難だった。
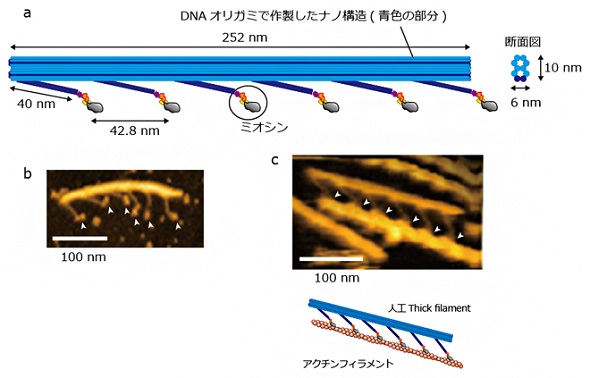
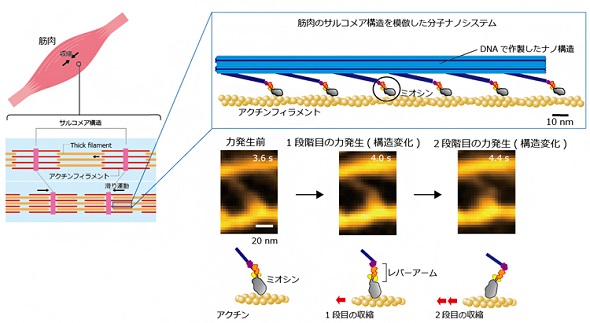
今回、共同研究チームは、筋肉収縮時におけるミオシンの構造変化を直接観察するための技術を開発した。筋収縮の際、ミオシンが集団になったフィラメント(thick filament)とアクチンフィラメントが平行になって、互いに滑り合うが、その動きを再現する。
まず、DNAを折り紙のように折りたたんでナノ構造物を作り上げる「DNAオリガミ技術」で足場を作成し、ヒト筋肉のミオシンを連結して天然同様のナノシステム(人工thick filament)を設計した。これにより、人工thick filamentに沿ってアクチンフィラメントが滑る時のミオシンの分子形状を高速原子間力顕微鏡で観察し、高解像度で画像化することに成功した。
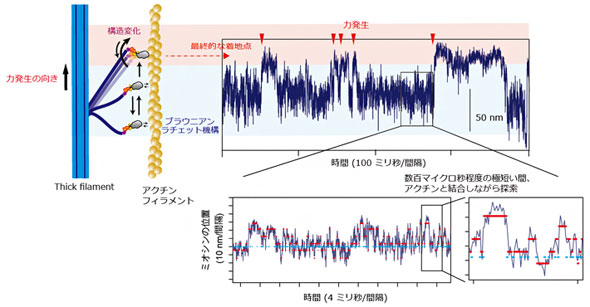
画像化により、ミオシンのレバーアームと呼ばれる部位が収縮時に2段階で構造変化を起こし、力が発生して十分な収縮が引き起こされる様子が確認できた。さらに詳しく観察したところ、レバーアームがthick filament内の別のミオシンの影響を受け、1段階目の構造変化で発生した力により、停止状態で運動を終える「収縮」や、1段階目で力が発生した後、逆方向に構造が変化して、力が発生する前の構造に戻る「弛緩」、再度、構造変化を起こして力が発生する「収縮」など、柔軟な動きで収縮を引き起こしていることが分かった。
次に、人工thick filamentの一部に、アクチンと安定して結合するタンパク質を導入し、ミオシンがアクチンから外れにくくなるようにした。レーザー暗視野顕微鏡と高速撮影カメラで、収縮の瞬間のミオシン分子の動きを捉えたところ、ミオシン分子がアクチンフィラメントに沿ってランダムに動きながら、収縮に必要な構造変化を起こすための最適な場所を探索している様子が観察された。また、ランダムな動きから方向性を持って最終的な着地点を選んでいることから、「ブラウニアンラチェット」と呼ばれる機構が作用していることも判明した。
筋収縮の瞬間を直接的に画像化できたことにより、今後は肥大型心筋症の要因となるミオシン変異体を分子レベルで詳細に診断可能になる。さらには、今回開発した技術が、医療への応用にとどまらず、人工筋肉やナノレベルのエネルギー変換装置、メカノバイオロジーへ貢献することも期待される。
関連記事
 心臓リンパ管の機能不全が冠動脈のけいれんに関与することを証明
心臓リンパ管の機能不全が冠動脈のけいれんに関与することを証明
東北大学は、心臓リンパ管の異常が冠動脈のけいれん(冠攣縮)の原因となることを、ブタモデルを用いて証明した。薬剤抵抗性の難治性冠攣縮性狭心症において、心臓リンパ管が新規治療標的となることが期待される。 心電図から心臓カテーテル治療の要否を瞬時に判断するAI技術
心電図から心臓カテーテル治療の要否を瞬時に判断するAI技術
慶應義塾大学は、AIを応用して、1枚の心電図から、その患者にカテーテル治療が必要かどうかを80%以上の精度で瞬時に判定する技術を開発した。救急外来における心筋梗塞などの治療の早期化、効率化に貢献する。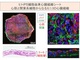 難治性不整脈を再現、ヒトiPS細胞由来の3次元的心臓組織で
難治性不整脈を再現、ヒトiPS細胞由来の3次元的心臓組織で
京都大学はヒトiPS細胞由来の3次元的心臓組織を作製し、不整脈の一種であるTdPを培養下に再現することに成功した。難治性不整脈の治療法開発や、さまざまな薬の毒性評価に役立つと期待される。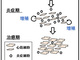 心筋炎の治癒過程で増殖する心筋細胞を発見、心臓の再生/修復への応用見込む
心筋炎の治癒過程で増殖する心筋細胞を発見、心臓の再生/修復への応用見込む
大阪大学は、増殖能を失うとされていた哺乳類成体の心筋細胞について、心筋炎が自然治癒する過程で心筋細胞が増殖することを明らかにした。このメカニズムをさらに検討すれば、心筋細胞を人為的に増殖させる技術開発につながるという。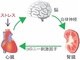 心不全から身体を守るのは「心臓・脳・腎臓をつなぐ臓器ネットワーク」
心不全から身体を守るのは「心臓・脳・腎臓をつなぐ臓器ネットワーク」
千葉大学は、心不全に関わる新しいメカニズムを解明した。心臓をストレスから守るために心臓と脳、腎臓をつなぐ臓器ネットワークと、それにおいて重要な心不全発症の鍵となるタンパク質を発見した。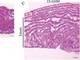 細胞が生きた状態で心臓組織シートを簡便に積層化する方法を開発
細胞が生きた状態で心臓組織シートを簡便に積層化する方法を開発
京都大学は、ゼラチンハイドロゲル粒子を利用することで、マウスES細胞から作製した心臓組織シートを簡便に積層化する手法を確立。このシート15枚を積層化し、細胞が生きた状態で厚さ約1mmにすることに成功したと発表した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
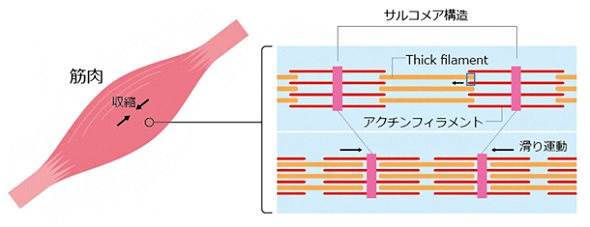 筋収縮時に起こる滑り運動 出典:理化学研究所
筋収縮時に起こる滑り運動 出典:理化学研究所