大腸がん幹細胞を標的とした治療モデルの開発に成功:医療技術ニュース
慶應義塾大学は、大腸がんの増殖をつかさどる「がん幹細胞」の詳細な機能の解析と、がん幹細胞を標的とした治療モデルの開発に成功した。がんの新たな根源的治療法の開発につながることが期待される。
慶應義塾大学は2017年3月31日、大腸がんの増殖をつかさどる「がん幹細胞」の詳細な機能の解析と、がん幹細胞を標的とした治療モデルの開発に成功したと発表した。同大学医学部の佐藤俊朗准教授らによるもので、成果は同年3月29日に英科学誌「Nature」に掲載された。
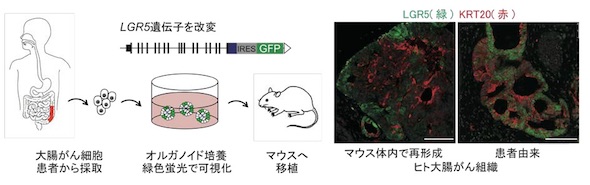
正常な大腸上皮の組織には幹細胞があるが、幹細胞だけが発現する遺伝子として考えられているのがLGR5だ。その分化細胞はKRT20という遺伝子を発現する。大腸がんも、正常な組織と同様にLGR5とKRT20で構成され、LGR5を頂点とするヒエラルキー構造を持つという。
佐藤准教授らは先行研究で、ヒトの大腸がんを培養し、マウス生体内でがんを再構築する技術(オルガノイド培養技術)を開発した。今回の研究では、この技術にゲノム編集技術を応用し、LGR5の遺伝子領域に緑色蛍光タンパク質(GFP)を組み込んだ遺伝子改変オルガノイドを作製した。これをマウスに移植して再形成したヒト大腸がん組織は、患者由来と同様のLGR5のヒエラルキー構造を示していた。これにより、ヒト大腸がんの特定の細胞について生体内での動態を観察できるようになった。
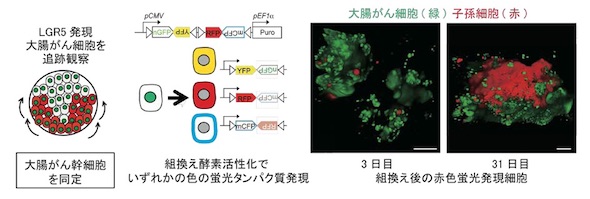
さらに、細胞系譜解析によってLGR5発現がん細胞の子孫細胞を蛍光タンパク質で可視化した。同手法により、たった1つのLGR5発現がん細胞が自分自身を産生しつつ、分化した子孫細胞を増やしながらがん組織を増大させる様子を捉えることに成功。この結果、ヒト大腸がん組織内にがん幹細胞が存在することが裏付けられた。
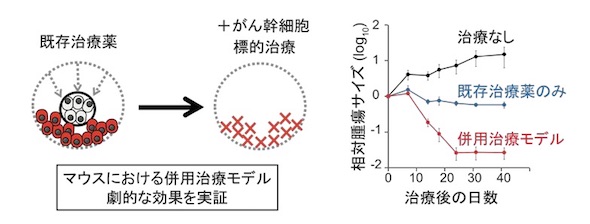
また、開発した治療モデルにより、がん幹細胞を特異的に殺傷する標的治療だけでは根源的治療が難しいことが確認された。治療を中止すると腫瘍が再び増大し、殺傷したはずのLGR5発現がん幹細胞が再度出現することもあった。そのため、LGR5幹細胞を殺傷した後にKRT20発現がん細胞の系譜解析をしたところ、LGR5発現がん幹細胞への「先祖返り」(脱分化)が観察され、腫瘍増大に寄与することが分かった。
次に、既存のがん治療薬とがん幹細胞標的治療を組み合わせて、その治療効果を検証した。がん治療薬セツキシマブ投与の後にがん幹細胞標的治療を行うと、腫瘍の著しい縮小が確認された。治療薬と標的治療、もしくは一方のみでは根治には至らず、両方を組み合わせた場合にのみ、根本的治療が可能であることが示された。
同成果は、今後の大腸がんの根治を目指したがん幹細胞機能の解明や、臨床で使用できるがん幹細胞標的治療薬の開発、分化がん細胞のがん幹細胞への脱分化を抑制して再発を予防する治療法の開発などにつながることが期待される。
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
関連記事
 がんプレシジョン医療にAIを活用、治療率が6倍に
がんプレシジョン医療にAIを活用、治療率が6倍に
がん研究会、がん研究所、FRONTEOヘルスケアは、最先端のゲノム解析技術とAI(人工知能)を用いて「がんプレシジョン医療」を実現するシステムの開発に向けた共同研究を開始する。現在、一般的で明確ながん治療法が当てはまらないがん患者の治療率は5%程度だが、共同研究により治療率を6倍の30%まで高められる可能性がある。 第5世代量子線がん治療装置の早期開発に向けて5者が協力
第5世代量子線がん治療装置の早期開発に向けて5者が協力
量子科学技術研究開発機構と住友重機械工業、東芝、日立製作所、三菱電機は、「第5世代量子線がん治療装置の開発協力に関する包括的協定」を締結した。小型で建設コストが安い装置の早期開発に向け、各社の人材や装置・施設などを活用する。 中性子でがん細胞を選択的に治療するBNCT装置、リチウムターゲットで小型化
中性子でがん細胞を選択的に治療するBNCT装置、リチウムターゲットで小型化
CICSは、「イノベーション・ジャパン2015」において、ホウ素捕捉中性子療法(BNCT)を用いたがん治療装置を紹介した。独自に開発したリチウムターゲットと加速器の組み合わせによる小型化を特徴としている。 ゲノム情報を医療に役立てる、マイクロRNAによるがん治療から個別先制医療まで
ゲノム情報を医療に役立てる、マイクロRNAによるがん治療から個別先制医療まで
東京医科歯科大学 難治疾患研究所 分子細胞遺伝分野 教授の稲澤譲治氏が「ゲノム情報を通して人々の幸せに貢献する」をテーマに講演を行った。稲澤氏の研究は、マイクロRNAによるがん治療から、臨床情報とゲノム情報を組み合わせたデータベースを基にした個別先制医療まで広範囲にわたる。 神経ネットワーク活動を統合するメカニズムを解明
神経ネットワーク活動を統合するメカニズムを解明
慶應義塾大学は、神経ネットワーク活動の統合に必須であり、てんかんや自閉症を引き起こす原因の1つと考えられるカイニン酸受容体が、シナプスに組み込まれるメカニズムを解明したと発表した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
コーナーリンク