手のひらサイズの血管チップでがん転移過程の一部を可視化:医療技術ニュース
東京大学は、3次元の血管構造周囲にがん細胞集団を配置した3次元in vitroモデル「がん-微小血管チップ」を開発し、がん細胞が血管に浸潤しがん細胞の塊を形成するまでの一連のプロセスを可視化した。
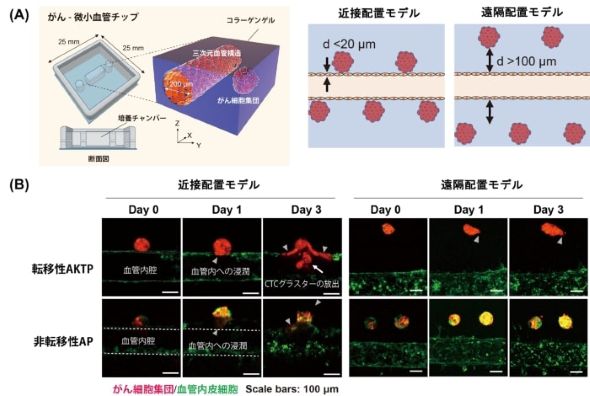
東京大学は2025年5月22日、3次元の血管構造周囲にがん細胞集団を配置した3次元in vitroモデル「がん-微小血管チップ(tumor-microvessel on-a-chip)」を開発し、がん細胞が血管に浸潤して、がん細胞の塊(CTCクラスタ)を形成するまでのプロセスを可視化したと発表した。分子標的薬の開発や薬剤スクリーニングへの応用が期待される。
CTCクラスタは、進行がん患者の血中で見られ、高い転移発生率との関連性が示唆されている。今回開発したがん-微小血管チップは、マイクロ流体デバイス技術を用いて、がん細胞集団と血管を3次元的に配置する培養デバイスだ。がん転移の初期過程で、がん細胞集団と血管との相互作用を明らかにするために作成された。
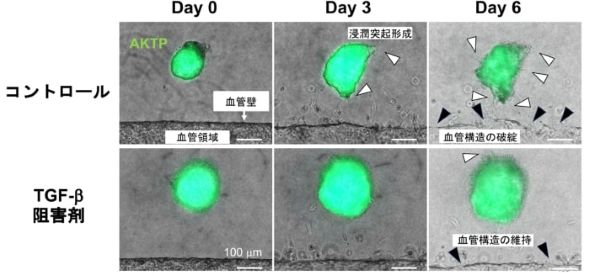
転移能の異なる2種類の腸管由来腫瘍オルガノイドを用いて、がんと血管との距離を制御した「近接配置モデル」「遠隔配置モデル」を作製して観察した。その結果、転移性の高いAKTPオルガノイドは、近接配置モデルでは血管の構造を取り込んで共有するvessel co-option(血管の乗っ取り)、CTCクラスタの血管内への放出が認められた。一方、非転移性であるAPオルガノイドでは、クラスタの放出はまれで、転移性と非転移性のがん細胞集団間で浸潤パターンが明確に異なることが示された。
さらに、分子メカニズム解析と遺伝子発現解析から、がん細胞由来のトランスフォーミング増殖因子β(TFG-β)が内皮細胞にEndoMT(内皮-間葉転換)を誘導し、内皮細胞が分泌するTGF-βファミリーの一員であるActivinによりがんの浸潤性を高める「がん-血管相互作用による悪性化の連鎖」が、CTCクラスタの血管侵入と形成に重要であることが明らかとなった。
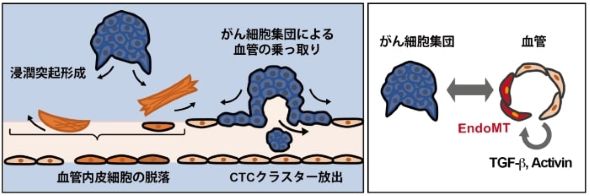 研究成果の模式図。(左)転移性がん細胞集団(AKTP細胞)はEndoMTを誘導し、血管を乗っ取りCTCクラスタを放出する。(右)がん細胞集団が血管内皮細胞に作用し、血管内皮細胞側のTGF-βおよびActivinの発現上昇による、がん-血管相互作用による悪性化の連鎖が進行する[クリックで拡大] 出所:東京大学
研究成果の模式図。(左)転移性がん細胞集団(AKTP細胞)はEndoMTを誘導し、血管を乗っ取りCTCクラスタを放出する。(右)がん細胞集団が血管内皮細胞に作用し、血管内皮細胞側のTGF-βおよびActivinの発現上昇による、がん-血管相互作用による悪性化の連鎖が進行する[クリックで拡大] 出所:東京大学CTCクラスタと転移発生率の関連性は示唆されていたものの、その発生過程は明らかになっていなかった。今回の研究成果は、がん転移メカニズムの解明や治療標的分子の探索などに貢献するプラットフォームとなることが期待される。
関連記事
 深層学習を活用し、眼底画像から個人の血圧や血糖値を推定するAIモデルを公開
深層学習を活用し、眼底画像から個人の血圧や血糖値を推定するAIモデルを公開
国立情報学研究所は、学会主導データベース「Japan Ocular Imaging Registry: JOIR」で収集した画像データを活用し、眼底画像から個人の血圧や血糖値を推定するAIを開発した。Webサイトから無償でダウンロードできる。 布団の上から読み取り可能な医療用RFIDリストバンドを提供開始
布団の上から読み取り可能な医療用RFIDリストバンドを提供開始
サトーは、大人から小児まで使用できる医療用RFIDリストバンド「RFIDスマートケアバンド」の提供を開始する。従来品よりもRFIDの読み取り精度が向上し、布団の上からでもリストバンドの情報を読み取れる。 遺伝性角化症の国際病名を、病因遺伝子を組み入れた新病名へと改訂
遺伝性角化症の国際病名を、病因遺伝子を組み入れた新病名へと改訂
世界各国から集まった遺伝性角化症の専門家と患者会の代表で構成される、表皮分化疾患病名改訂イニシアティブは、遺伝的な表皮の分化障害による疾患の国際病名を包括的かつ抜本的に改訂した。 色の変化で力を可視化するウェアラブルセンサー
色の変化で力を可視化するウェアラブルセンサー
東京大学 生産技術研究所は、力の強さを色の変化で可視化するウェアラブルセンサーを開発した。力を加えると色が変わるメカノクロミックポリマーの構造をナノスケールで制御し、感度を最大14倍に高めた。 大腸内視鏡検査で視野を確保する先端アタッチメントを発売
大腸内視鏡検査で視野を確保する先端アタッチメントを発売
オリンパスは、大腸内視鏡の先端部に装着し、大腸粘膜のひだを広げて視野を確保する処置具「ENDOCUFF VISION」を発売した。8本のフレキシブルアームが大腸のひだを平らにし、見えにくかった部分の視認性を向上させた。 高精細画質とスムーズな操作性を持つ手術映像撮影用4Kカメラを発表
高精細画質とスムーズな操作性を持つ手術映像撮影用4Kカメラを発表
EIZOは、手術室向け4K/60p術野カメラシステム「CuratOR SC431」を発表した。スムーズに操作できる3軸雲台一体化構造を雲台部に採用した他、新たに「映像ブレ補正機能」を搭載する。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク