ゲノム情報を医療に役立てる、マイクロRNAによるがん治療から個別先制医療まで:医療技術ニュース(1/2 ページ)
東京医科歯科大学 難治疾患研究所 分子細胞遺伝分野 教授の稲澤譲治氏が「ゲノム情報を通して人々の幸せに貢献する」をテーマに講演を行った。稲澤氏の研究は、マイクロRNAによるがん治療から、臨床情報とゲノム情報を組み合わせたデータベースを基にした個別先制医療まで広範囲にわたる。
東京医科歯科大学は2016年2月18日、東京都内で記者懇談会を開催し、同大学 難治疾患研究所 分子細胞遺伝分野 教授の稲澤譲治氏が「ゲノム情報を通して人々の幸せに貢献する」をテーマに講演を行った。
稲澤氏が研究対象としているのは、がんの個別化医療につながる「がんと遺伝性疾患の統合的オミクス研究」だ。オミクスとは、生物の体の中にある分子全体を網羅的に調べる学問であり、稲澤氏は、がんや遺伝性疾患の治療にその成果を適用すべく研究を続けている。
ヒト体細胞核DNAの塩基対の数は64億。これは世界の人口71億人とほぼ同じ数だ。がんを引き起こすゲノム異常は、染色体レベルから塩基レベルまでさまざまだが、これを地球に当てはめると、染色体レベルは国や大陸、塩基レベルはヒト1人に相当する。稲澤氏は「こういった全くスケールの異なるものが原因になってがんが引き起こされる」と説明する。
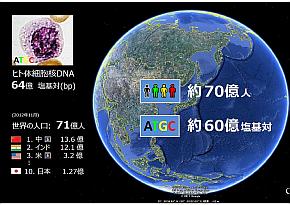
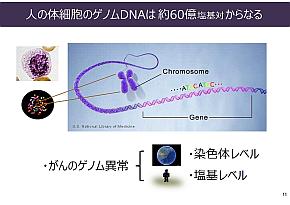 世界の人口とヒト体細胞核DNAの塩基対の比較(左)。がんのゲノム異常はさまざまなレベルで起こるが、染色体レベルは国や大陸、塩基レベルはヒト1人に相当するという(右)(クリックで拡大) 出典:東京医科歯科大学
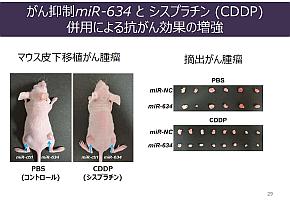
世界の人口とヒト体細胞核DNAの塩基対の比較(左)。がんのゲノム異常はさまざまなレベルで起こるが、染色体レベルは国や大陸、塩基レベルはヒト1人に相当するという(右)(クリックで拡大) 出典:東京医科歯科大学稲澤氏が研究の代表例として挙げたのが、がんの増殖を抑える小さな分子「マイクロRNA」である。マイクロRNAは22の塩基対から成り、極めて小さい単位になる。このマイクロRNAの中に、がんを抑制する遺伝子型を持つものがあり、これを抗がん核酸薬として利用できるように研究を進めている。
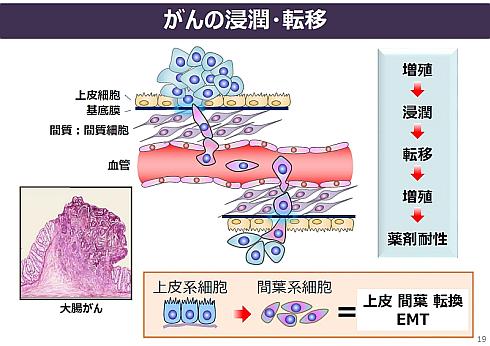
最も注目しているのは、がんの最大の課題である浸潤と転移を抑制するマイクロRNAである。稲澤氏は「転移を制する者はがんを制すという言葉もあるほどで、がん治療で最も重要な課題」と強調する。一般的にがんは、上皮系細胞で発生した異常から始まる。この上皮系細胞が上皮系細胞のままである限り、浸潤と転移は起きにくい。しかし、上皮系細胞が間葉系細胞に転換すると、間質細胞に浸潤し、血管に入り込む。そして、血流に乗って他の場所に転移するのだ。
稲澤氏は、上皮系細胞が間葉系細胞に転換する「上皮−間葉転換(EMT)」を抑制するマイクロRNAや、がんの細胞死を誘導するマイクロRNAなどの探索を行っている。しかし、これらのマイクロRNAは「体内では数十秒で分解してしまう」(同氏)という課題がある。そこで、ヒトの体内で効果を発揮できるように届けるDDS(Drug Delivery System)の研究開発を、国内製薬企業など2社との連携でスタートさせている。
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
 東京医科歯科大学の稲澤譲治氏
東京医科歯科大学の稲澤譲治氏