骨髄の空洞を維持する遺伝子が見つかる、再生医療や骨粗しょう症治療に期待:医療技術ニュース
大阪大学は、間葉系幹細胞で発現する転写因子Ebf3が、血液細胞の工場である骨髄腔を維持し、血液細胞を育てる微小環境を作っていることを明らかにした。
大阪大学は2018年4月4日、間葉系幹細胞で発現する転写因子Ebf3が、血液細胞の工場である骨髄腔(骨の中心部の空洞で血液細胞の工場)を維持し、血液細胞を育てる微小環境(ニッチ)を作っていることを明らかにしたと発表した。同大学大学院医学系研究科 教授の長澤丘司氏らの研究グループによるものだ。
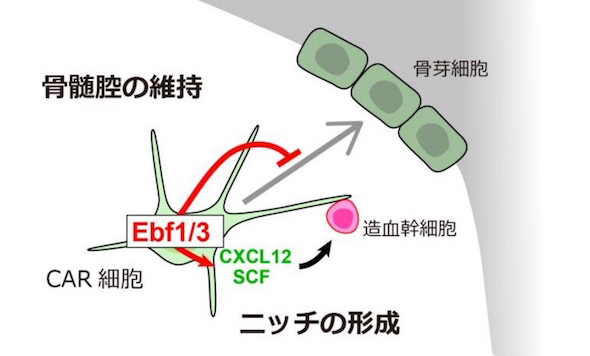
血液細胞は、少数の造血幹細胞から毎日産生され続けている。造血は骨髄でのみ行われており、造血幹細胞は骨髄のニッチと呼ばれる環境によって維持されている。CAR細胞は、ニッチを供給する骨髄特有の細胞だ。造血幹細胞と接着する細胞突起を持っており、血液細胞を育てる他に、脂肪細胞や骨芽細胞を生み出すことが分かっている。しかし、骨の中心部分に造血のための大きな空洞(骨髄)が維持される仕組みは明らかでなかった。
今回、同研究グループは、マウスを用いて、CAR細胞のみで高発現する転写因子Ebf3を見出した。そして、Ebf3を発現する細胞に目印をつけることで、CAR細胞が生涯、骨芽細胞と脂肪細胞を供給する間葉系幹細胞であることを証明した。
さらに、マウスのCAR細胞でEbf3を欠損させた場合、老齢になると、骨髄に骨が増加し、骨髄の空洞がほとんどなくなってしまった。そのマウスでは、CAR細胞の大部分が骨芽細胞の前駆細胞に分化し、造血幹細胞や造血を維持できなくなっていた。
生体にはEbf3とよく似たEbf1という分子が存在する。これがEbf3の機能を補っている可能性がある。そこで両方をCAR細胞で欠損させたところ、生まれた直後は骨髄が正常に存在していたが、若年期から骨髄が骨で埋まってしまった。CAR細胞の大部分が骨芽細胞の前駆細胞に分化し、造血幹細胞や造血を維持できなくなっていた。
これらのことから、Ebf3は骨芽細胞への分化を抑制することで骨髄の空洞を維持し、血液細胞を育てるニッチを作っていることが分かった。これは、すでに明らかになっている、CAR細胞の脂肪細胞への分化を抑制する遺伝子Foxc1と合わせ、ニッチの供給に必須だ。
この成果により、造血不全に対し、Ebf3やその上流または下流で働く遺伝子を用いて、試験管内で造血幹細胞ニッチを作製することで、造血幹細胞や血液細胞を作って補う再生医療につながると期待されるとしている。また、骨が減少する骨粗しょう症疾患の治療に役立つ可能性もあるという。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 蚊が液体を飲みこむのは2パターン、血液はゴクゴクで花の蜜はゴックン
蚊が液体を飲みこむのは2パターン、血液はゴクゴクで花の蜜はゴックン
東北大学は、蚊が餌を飲み込む際に、2つのポンプを巧みに使い分けていることを発見した。この研究成果は将来的に、感染症が広がるメカニズムの解明やマイクロスケールの流体駆動デバイス設計に役立つことが期待される。 血液検査でひきこもり傾向が明らかに、「治療法」の開発に期待
血液検査でひきこもり傾向が明らかに、「治療法」の開発に期待
九州大学は、ひきこもり傾向に関連する血中バイオマーカーを発見した。ひきこもりの病態解明の進展やひきこもりの予防、早期介入、栄養療法などの治療法開発に貢献することが期待される。 血糖値の変化に応じて血中から脳内に薬剤を届けるナノマシンを開発
血糖値の変化に応じて血中から脳内に薬剤を届けるナノマシンを開発
ナノ医療イノベーションセンターは、脳への薬剤送達を妨げる「血液脳関門(Blood-brain barrier:BBB)を血糖値の変化に応じて効率的に通過し、脳内へ集積する「BBB通過型ナノマシン」を開発した。 尿や血液から、酸化ストレスを簡便に検出
尿や血液から、酸化ストレスを簡便に検出
理化学研究所は、酸化ストレス疾患のマーカーを、抗体を使わず市販の安価な試薬だけで簡便に検出する方法を開発した。大量のサンプルを一度に短時間で測定でき、従来の手法に比べて1万分の1以下のコストで実施できる。 膵がん早期診断の血液バイオマーカーを発見、検査キットの開発にも成功
膵がん早期診断の血液バイオマーカーを発見、検査キットの開発にも成功
国立がん研究センターは、米国立がん研究所との共同研究で、血液中のアポリポプロテインA2(apoA2)アイソフォームを測定することで、既存のバイオマーカーに比べて高い精度で早期膵がんを検出できることを確認した。