リアルワールドエビデンスに基づく医療機器開発の時代へ:海外医療技術トレンド(28)(1/3 ページ)
米国では「21世紀医療法」に基づく医療イノベーション推進策が本格化しており、ヘルスデータ利活用の領域まで及んでいる。そこで重視されているのが「リアルワールドデータ(RWD)」と「リアルワールドエビデンス(RWE)」だ。
前回の連載第27回で触れたように、米国の「21世紀医療法」に基づく医療イノベーション推進策は、医療機器における「リアルワールドデータ(RWD)」利活用でも本格化してきた。
米国FDAが医療機器向けリアルワールドデータ利用指針を策定
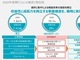
 図1 米国FDA「医療機器の規制に係る意思決定を支援するリアルワールドエビデンス利用 - 業界および食品医薬品局スタッフ向けガイダンス」(クリックで拡大) 出典:FDA「Use of Real-World Evidence toSupport Regulatory Decision-Making for Medical Devices - Guidance for Industry and Food and Drug Administration Staff.」(2017年8月31日)
図1 米国FDA「医療機器の規制に係る意思決定を支援するリアルワールドエビデンス利用 - 業界および食品医薬品局スタッフ向けガイダンス」(クリックで拡大) 出典:FDA「Use of Real-World Evidence toSupport Regulatory Decision-Making for Medical Devices - Guidance for Industry and Food and Drug Administration Staff.」(2017年8月31日)2017年8月31日、米国食品医薬品局(FDA)は、「医療機器の規制に関わる意思決定を支援するリアルワールドエビデンス利用 - 業界および食品医薬品局スタッフ向けガイダンス」(図1参照:関連情報、PDFファイル)を公表した。
FDAは、リアルワールドデータについて、さまざまなソースから日常的に収集される、患者の健康状態および/または医療の提供に関連するデータと定義し、具体例として、電子健康記録(EHR)から派生したデータ、請求/支払データ、製品/疾病登録データ、家庭用機器に含まれる患者生成データ、モバイルデバイスなど健康状態を知らせることができるその他のソースから収集されたデータなどを挙げている。
また、「リアルワールドエビデンス(RWE)」については、リアルワールドデータの分析から派生した医療製品の利用や潜在的ベネフィット又はリスクに関連する臨床的エビデンスと定義している。FDAは、リアルワールドエビデンスを生成するために利用したリアルワールドデータが、特定の規制に関わる決定を告知またはサポートするのに十分な品質を有すると判断した時、リアルワールドエビデンスの利用が、医療機器の規制に関わる意思決定をサポートするという見解を示している。そして、具体的なリアルワールドエビデンスの用途として、以下のような例を挙げている。
- 前向き臨床研究で検証する仮説を策定するため
- ベイズ流試験の事前の歴史的対照群として
- 階層モデルまたはハイブリッド型データ統合における1つのデータソースとして
- 登録またはシステマチックなデータ収集メカニズムが存在するところで、機器の承認かたはクリアランスをサポートするための臨床研究に関連する同時対照群またはデータ収集メカニズムとして
- バイオマーカーの臨床的妥当性を特定、促進またはサポートするエビデンスとして
- 人道機器適用免除、事前承認申請(PMA)、De Novoの承認または付与をサポートするエビデンスとして
- 連邦食品・医薬品・化粧品法第513条(e)または(f)(3)に基づく医療機器再分類の請願のサポートとして
- 適応の追加または安全性と効果に関する新たな情報を含む表示への更新を含む機器表示の拡大のためのエビデンスとして
- 公衆衛生サーベイランスの努力のため、継続的なサーベイランスを通じて、医療機器に付随する安全性の問題となる可能性を示すシグナルが時々特定される。リアルワールドエビデンスは、適切に調整する行動とコミュニケーションを知らせる目的でシグナルを洗練するために利用される可能性がある
- 機器承認の条件として課せられる市販後調査を実行するため、または連邦食品・医薬品・化粧品法第522条に基づき課せられる市販後調査のニーズを潜在的に排除するため
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 医療および製薬DX市場は2035年に1.3兆円規模へ、AI創薬が急成長のけん引役に
コーナーリンク