リアルワールドエビデンスに基づく医療機器開発の時代へ:海外医療技術トレンド(28)(2/3 ページ)
» 2017年10月13日 10時00分 公開
[笹原英司,MONOist]
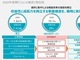
リアルワールドデータに要求される妥当性と信頼性
次に、FDAは、リアルワールドデータが、規制に関わる意思決定に要求される十分な品質を満たしているか否かを判断する評価基準として「妥当性(Relevance)」と「信頼性(Reliability)」を掲げている。
このうち規制に関わる利用に適した「妥当性」に関連する要素として、以下のようなものを挙げている。
- リアルワールドデータが、集団において、関心のある機器、露出、アウトカムの利用を捉えるために十分な詳細を含んでいる(例:データを手近な質問に適用する)
- 妥当で適切な分析手法が適用された時、分析に利用可能なデータの要素で、特定の質問を処理することができる(例:データに通常の臨床/統計分析を施すことができる)
- 提供されるリアルワールドデータとリアルワールドエビデンスが、既知の臨床/科学的判断を利用して、解釈可能である
他方、「信頼性」に関連する要素として、「データの発生」と「データの保証・品質コントロール」の2つを挙げている。これらのうち、「データの発生」に関連する具体的な要素として、以下のようなものを挙げている。
- 完全で正確なリアルワールドデータ収集に向けた個々のサイトの準備
- 共通のデータ捕捉フォームを利用したか
- 共通の定義フレームワーク(例:データ辞書)を利用したか
- 主要なデータポイント収集のための共通な時間的フレームワークのアドヒレンス
- リアルワールドデータの収集または検索に関連する研究計画、プロトコル、そして/または分析計画を策定するタイミング
- データ要素の捕捉のために利用するソースおよび技術手法
- 患者の選定および登録の基準がバイアスを最小化し、リアルワールド集団の代表性を保証しているか
- データ入力、伝送、可用性の適時性
- 必要で十分な患者の保護は整っているか
さらに、「データの保証・品質コントロール」に関連する具体的な要素として、以下のようなものを挙げている。
- データ要素の集団の品質
- 完全性と一貫性のための、ソース検証の手順とデータ収集・記録の手順のアドヒレンス
- 特定の分析に必要なデータの完全性
- サイトおよび時間の枠を超えたデータの一貫性
- データ収集と参加サイトにおけるデータ辞書利用のための継続的なトレーニングプログラムの評価
- サイトとデータのモニタリング業務の評価
- データ品質監査プログラムの利用
Copyright © ITmedia, Inc. All Rights Reserved.
Special ContentsPR
特別協賛PR
スポンサーからのお知らせPR
Special ContentsPR
Pickup ContentsPR
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 医療および製薬DX市場は2035年に1.3兆円規模へ、AI創薬が急成長のけん引役に
Special SitePR
コーナーリンク
あなたにおすすめの記事PR