アルツハイマー病の初期に蓄積するアミロイドタンパク質の新たな立体構造:医療技術ニュース
京都大学は、アルツハイマー病患者の脳において、特に疾患初期に蓄積する老人斑に固有と考えられる繊維状アミロイドβタンパク質の新たな立体構造を発見したと発表した。
京都大学は2015年5月18日、アルツハイマー病患者の脳において、特に疾患初期に蓄積する老人斑に固有と考えられる、繊維状アミロイドβタンパク質の新たな立体構造を発見したと発表した。同大医学研究科の星美奈子特定准教授(先端医療振興財団客員上席研究員)が、Yoshitaka Ishii University of Illinois at Chicago教授、Ruth Nussinov National Cancer Institute at Frederick主任研究員のグループと共同で研究したもの。
アルツハイマー病は、40〜43残基の長さを持つAβペプチドが集合し、毒性を持つことで発症すると考えられている。そのため、Aβの構造解析が必要とされていたが、ペプチド自身に複数の種類があり、環境に応じて機能が異なるさまざまな集合体を作るため、ハードルが高い領域の1つとされていた。
これまで、Aβの中でも42残基のもの(以下、Aβ1-42)の方がAβ1-40に比べて凝集体を形成しやすいこと、形成された凝集体の毒性が高いことが明らかにされてきた。さらに、疾患初期に認められる老人斑では、Aβ1-42から形成されていること、遺伝的な家族性のアルツハイマー病では、Aβ1-42の形成効率が高まることなど、Aβ1-42の方がより発症を促進している可能性が示唆されていた。しかし、それが分子レベルでどのような違いをもたらしているかは明らかにされていなかった。
今回の研究では、サンプル調製を工夫することで、Aβ1-42だけが形成できる「トリプルβシート」という立体構造を固体NMRによって明らかにした。この構造は、Aβ1-40では形成できず、また、この構造をAβ1-42に加えると、それを鋳型に同じ構造体を作るが、Aβ1-40ではできないことが分かった。
同成果は、Aβ1-42とAb1-40の違いについて、初めて分子レベルで解明したものとなる。Aβ1-42による構造はAβ1-40に伝播(でんぱ)されないことを示したことで、アルツハイマー病の初期において、1カ所で凝集が起これば、配列に依存して構造が増幅されていく可能性を提示した。このことは、アルツハイマー病脳の初期過程に迫る手がかりになるとしている。
なお、同研究成果は、2015年5月5日に英科学誌「Nature Structural & Molecular Biology」電子版に掲載された。
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
- 血液検査で認知症の予兆をキャッチする技術を開発
- 「週1回のチーズ」で認知症リスクが低下、明治らが1万人超の追跡調査で解明
- 浴室ぬめりや生乾き臭を1時間で撃退、負イオンがオゾンの酸化作用に作用
- 連邦政府封鎖明けからAI駆動型デジタルヘルス活用が急加速する米国の医療DX
- ゼブラフィッシュ胚でノロウイルスの人工合成に成功
関連記事
 γセクレターゼが基質をつかまえる、「箸」のような分子機構
γセクレターゼが基質をつかまえる、「箸」のような分子機構
東京大学の富田泰輔教授らの研究グループは、アルツハイマー病にかかわる酵素であるγセクレターゼが基質をつかまえる、「箸」のような分子機構を明らかにした。 がんや認知症を健診で簡単に発見、産官学共同で次世代診断システム開発へ
がんや認知症を健診で簡単に発見、産官学共同で次世代診断システム開発へ
新エネルギー・産業総合開発機構(NEDO)は、国立がん研究センター(以下、NCC)や東レなどが、健康診断などで簡単にがんや認知症を検査できる診断システムの開発プロジェクトを発表した。「マイクロRNA」と呼ばれるバイオマーカーを使って、1度の採血で13種類のがんを診断できるシステムの実用化を目指す。 脳波で動かす「マインドコントロールロボット」のデモ映像を公開、IEEE
脳波で動かす「マインドコントロールロボット」のデモ映像を公開、IEEE
IEEEは、米ミシガン州立大学 教授のディーン・アスラム氏が取り組む「マインドコントロールロボット」の研究に関するデモ映像を動画共有サービス「YouTube」に公開した。 脊髄小脳失調症モデルマウスの遺伝子治療に成功
脊髄小脳失調症モデルマウスの遺伝子治療に成功
東京医科歯科大学の岡澤均教授らの研究グループが、DNAの機能に大きな影響を与えるたんぱく質HMGB1を遺伝子治療的に補充することで、脊髄小脳失調症1型(SCA1)モデルマウスの寿命と運動能力が改善することを確認した。 産総研、生きた細胞の機能を光エネルギーで操作できる技術を開発
産総研、生きた細胞の機能を光エネルギーで操作できる技術を開発
生体透過性の高い近赤外レーザーで熱と活性酸素種を発生する有機色素と、カーボンナノホーンから成る分子複合体(ナノモジュレーター)を作製。この分子複合体を用いて、生きた細胞の機能を操作できる光制御技術を開発した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- ウシ由来の組織再生型靱帯で膝を切らずに再建、2028年実装目指す
- 血液凝固を約5分に短縮する真空採血管を発売、検査を迅速化
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- コンタクトをつけるだけで眼圧を測定、緑内障の早期発見へ
- アステラス製薬がヒト型ロボットによる細胞培養の自動化に向け、技術指定を取得
- すい臓がんの進行を抑制する遺伝子候補を発見
コーナーリンク
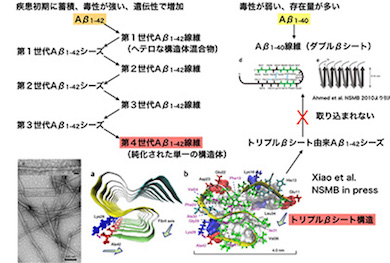 アミロイドβの42番目のアミノ酸がスイッチとなりS型のトリプルβシート構造ができる
アミロイドβの42番目のアミノ酸がスイッチとなりS型のトリプルβシート構造ができる


