脊髄小脳失調症モデルマウスの遺伝子治療に成功:医療技術ニュース
東京医科歯科大学の岡澤均教授らの研究グループが、DNAの機能に大きな影響を与えるたんぱく質HMGB1を遺伝子治療的に補充することで、脊髄小脳失調症1型(SCA1)モデルマウスの寿命と運動能力が改善することを確認した。
東京医科歯科大学は2014年12月15日、同大難治疾患研究所の岡澤均教授らが、DNAの機能に大きな影響を与えるたんぱく質HMGB1を遺伝子治療的に補充することで、脊髄小脳失調症1型(SCA1)モデルマウスの寿命と運動能力を改善することに成功したと発表した。科学技術振興機構(JST)の戦略的創造研究推進事業として行われたもので、神経変性疾患に対する遺伝子治療の開発につながることが期待できるという。
脊髄小脳失調症は、アルツハイマー病、パーキンソン病に次いで患者数の多い神経変性疾患。患者数は推定3万人とされ、その病態解明と治療開発が求められていた。
同研究グループでは、2007年に網羅的たんぱく質質量解析(プロテオミックス解析)を用いて、SCA1とハンチントン病の神経細胞モデルで共通して減少するたんぱく質「HMGB1」を発見。これを補充することで、SCA1ショウジョウバエモデルの神経変性が改善することを報告した。
今回の研究では、この成果を基盤として、SCA1モデルマウスを用いて、HMGB1を補充した場合の治療効果を調べた。実験では、HMGB1を過剰に発現させたマウスとの交配や、アデノ随伴ウイルス(AAV)ベクターを用いて外来性HMGB1を発現させる遺伝子治療を実施。いずれの実験結果でも、SCA1モデルマウスの寿命と運動能力が顕著に改善することが示されたという。これにより、哺乳類におけるHMGB1補充の有効性が確認されたほか、脳炎症などの副作用も見られなかった。
さらに、HMGB1がミトコンドリアに存在することを示し、その分布はミトコンドリア膜の内部であることを確認。HMGB1には、ミトコンドリアのDNA損傷を修復する機能があることも新たに分かった。この研究成果から、HMGB1補充により、核DNAだけでなく、ミトコンドリアDNAの損傷修復を介することでも治療効果を発揮することが示された。
これらの研究成果により、今後は、ウイルスベクターの改善、霊長類モデルでの検証などを経て、臨床試験への進展が期待されるという。
関連記事
 ライフテクノロジーズジャパン、遺伝子解析装置を日本で医療機器化
ライフテクノロジーズジャパン、遺伝子解析装置を日本で医療機器化
サーモフィッシャーサイエンティフィックの遺伝子解析装置「イオントレント Ion PGM Dx」を、日本でも医療機器として発売する。遺伝学的疾患・感染症・がんリスク診断のための高度な遺伝子解析ができる。 ゲノム、遺伝子、DNA、染色体は全て違う
ゲノム、遺伝子、DNA、染色体は全て違う
つまり、専門用語が難しいということ。 わずか1μLの血液で遺伝子型を判定、島津製作所の研究用装置
わずか1μLの血液で遺伝子型を判定、島津製作所の研究用装置
島津製作所が発売した「GTS-7000」は、わずか1μLの血液で遺伝子型を判定できる。試薬キットに含まれる溶解液と混合してから室温で5分ほど静置するだけで、分析装置にかけられるようになる。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク
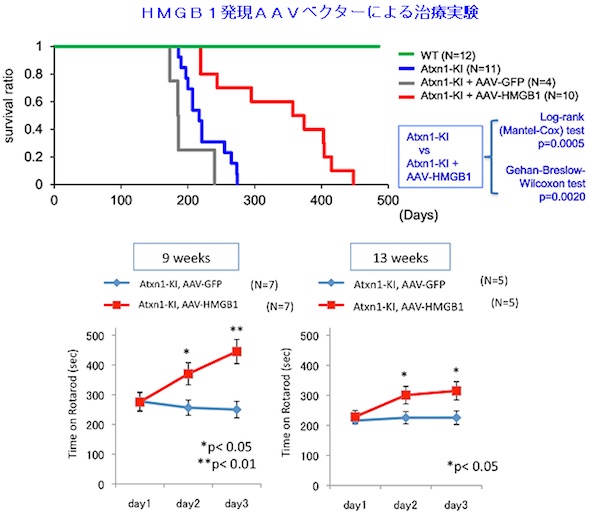 AAVウイルスベクターによるHMGB1発現は変異Atxn1ノックインマウスの寿命を顕著に延ばし、運動機能も改善する
AAVウイルスベクターによるHMGB1発現は変異Atxn1ノックインマウスの寿命を顕著に延ばし、運動機能も改善する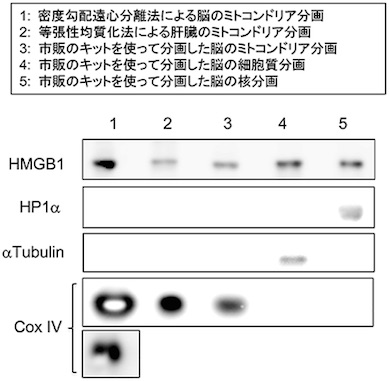 HMGB1はミトコンドリアに存在している
HMGB1はミトコンドリアに存在している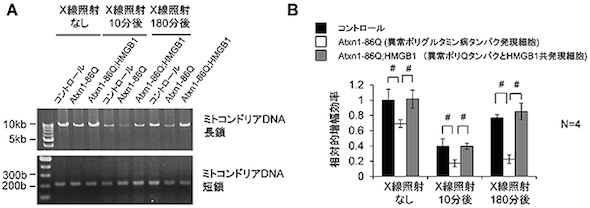 HMGB1はミトコンドリアDNAの損傷修復を促進する
HMGB1はミトコンドリアDNAの損傷修復を促進する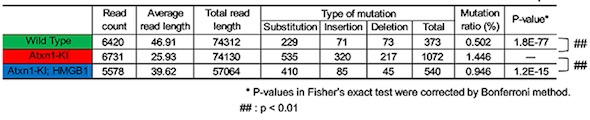 HMGB1はミトコンドリアDNA変異を減少させる
HMGB1はミトコンドリアDNA変異を減少させる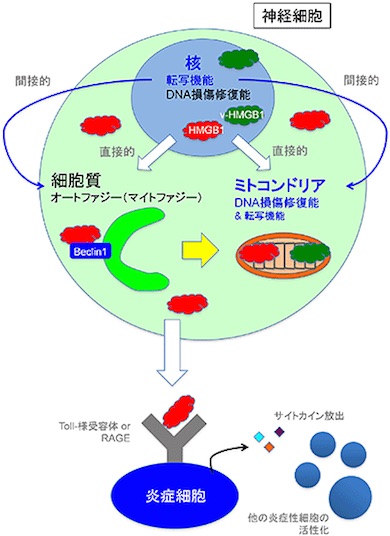 HMGB1が小脳変性を抑制する複数のメカニズム
HMGB1が小脳変性を抑制する複数のメカニズム


