卵巣がんの新たな発がんメカニズムを解明:医療技術ニュース
理化学研究所は、がんエピゲノムを標的としたマルチオミックス解析により、卵巣がんの新しい発がんメカニズムを解明した。予後不良な卵巣がんの新規治療法への応用が期待される。
理化学研究所は2023年10月4日、がんエピゲノムを標的としたマルチオミックス解析により、卵巣がんの新しい発がんメカニズムを解明したと発表した。予後不良な卵巣がんの新規治療法への応用が期待される。国立がん研究センター、島根大学らとの国際共同研究による成果だ。
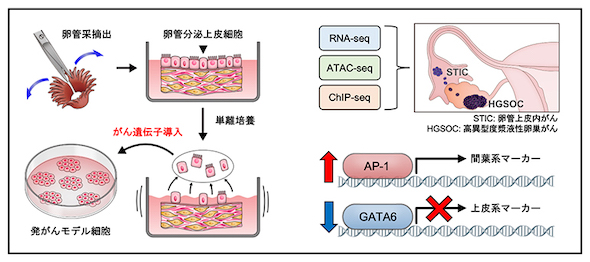
研究グループは、予後不良な高異型度漿液性卵巣がん(HGSOC)の新規治療法探索のため、DNAやヒストンの化学修飾によりゲノムの3次元構造や機能を調節するエピゲノムという仕組みの異常に注目した。
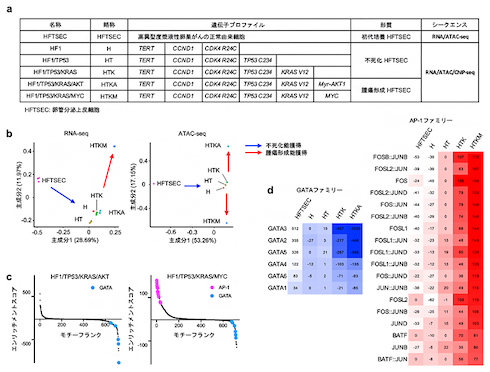
まず、HGSOCの発生母地である卵管分泌上皮細胞に段階的に遺伝子導入し、予後不良なサブタイプのHGSOC発がんモデル細胞を樹立し、網羅的なエピゲノム解析を含むマルチオミックス解析を実施した。その結果、腫瘍形成能を獲得する過程で、AP-1ファミリーの転写因子が活性化する一方で、GATAファミリーの転写因子が不活性化することが明らかとなった。
卵巣がん患者由来の組織を用いて発がんモデル細胞の解析結果を検証したところ、AP-1ファミリーの転写因子JUNの発現量が、前がん病変(卵管上皮内がん)組織とHGSOC組織で正常組織よりも高いことを確認した。前がん病変組織では活性化型JUNの発現量が増加していたことから、HGSOCの発生早期でJUNの発現上昇と活性化が重要なことが示唆された。
一方、GATAファミリーの転写因子GATA6とGATA6により転写されるタンパク質DAB2は、正常組織よりも前がん病変とHGSOCの組織で低下していた。DAB2遺伝子は卵巣がんのがん抑制遺伝子であり、がんを促進するRASシグナルを抑制する。
RASシグナルは、上皮細胞が転移能を獲得する機構の上皮間葉転換に関わっている。そこで、上皮間葉転換に重要なカドヘリン遺伝子を多く含む領域のゲノムエピゲノム解析したところ、HGSOCの発がん早期にエピゲノム異常を介したAP-1ファミリーとGATAファミリーの発現異常が複合的に作用し、上皮間葉転換が生じることが示唆された。
RASシグナルを阻害するMEK阻害剤を発がんモデル細胞に投与すると、発がん過程で低下していた複数遺伝子の発現量が回復した。
この結果から、MEK阻害剤がエピゲノム異常の修復に効果があることが明らかとなり、予後不良な卵巣がんの新たな治療法開発に貢献する可能性が示された。
関連記事
 青魚に含まれるEPA代謝物が花粉のアレルギー症状を抑えることを発見
青魚に含まれるEPA代謝物が花粉のアレルギー症状を抑えることを発見
東京大学は、マウスを使った実験で、ω-3脂肪酸EPAの代謝物5,6-DiHETEが、花粉によるアレルギー性結膜炎の症状を抑制することを発見した。青魚に多く含まれる代謝物のため、食事によるアレルギー性結膜炎の治療効果も期待される。 拠点を5倍に拡大、医療機器の修理や点検業務の受託サービスを強化
拠点を5倍に拡大、医療機器の修理や点検業務の受託サービスを強化
OKIクロステックは、医療機器の修理や点検業務の受託サービス体制を強化した。修理、点検ができる拠点を46拠点に拡大し、医療機器修理責任技術者を20人増員して300人体制とした。 通信機能付きの上腕式血圧計を発売、アプリで簡単にデータを管理
通信機能付きの上腕式血圧計を発売、アプリで簡単にデータを管理
オムロン ヘルスケアは、筒状のカフに腕を入れるだけで血圧を測定できる「オムロン 上腕式血圧計 HCR-1901T2」を発売した。通信機能を備え、測定データをアプリに転送して値の変化を表やグラフで確認できる。 食品用ラップのように脳表面に密着できる薄膜電極を開発
食品用ラップのように脳表面に密着できる薄膜電極を開発
東京工業大学は、脳表での電位記録と電気刺激の両立が可能な厚さ約8μmの薄膜硬膜下電極を開発した。複雑な曲面を持つ生体組織表面にも食品用ラップのように密着することが可能だ。 解読困難だったヒトゲノムの「暗黒領域」を読み解く
解読困難だったヒトゲノムの「暗黒領域」を読み解く
東京大学は、日本人健常者270人のゲノムデータを分析し、ヒトゲノムの中で暗黒領域と呼ばれる領域の1つである縦列反復配列の組成を明らかにした。 到着先でカートを自動で切り離せる病院用置き配型搬送ロボットを発売
到着先でカートを自動で切り離せる病院用置き配型搬送ロボットを発売
パナソニック プロダクションエンジニアリングは、病院内で薬剤や検体を自動搬送し、カートを到着場所で切り離す仕組みを備えた、置き配型搬送ロボット「HOSPI Trail」を発売する。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
 AP-1ファミリーの転写因子JUNの発現解析 出所:理化学研究所
AP-1ファミリーの転写因子JUNの発現解析 出所:理化学研究所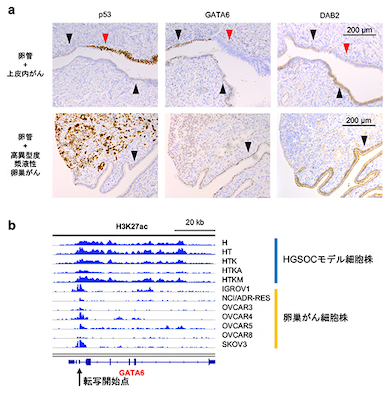 GATAファミリーのGATA6とその転写産物DAB2の発現解析 出所:理化学研究所
GATAファミリーのGATA6とその転写産物DAB2の発現解析 出所:理化学研究所


