炎症を促進するタンパク質の作用を解明、自己免疫疾患などの新しい治療法へ:医療技術ニュース
大阪大学は、炎症を促進させるRNA安定化分子「Arid5a」の炎症過程における局在制御機構を解明した。敗血症性ショックや自己免疫疾患などの新しい治療法の開発につながると期待される。
大阪大学は2018年2月6日、炎症を促進させるRNA安定化分子「Arid5a」の炎症過程における局在制御機構を解明したと発表した。この研究は、同大学免疫学フロンティア研究センター 特任教授の岸本忠三氏らの研究グループによるものだ。
免疫細胞は病原体を排除するために、インターロイキン6(IL-6)やTNFを代表とする炎症性サイトカインというタンパク質を分泌する。これが周りの免疫細胞を活性化させることで、炎症を誘導する。しかし、過剰または慢性化した炎症は、敗血症性ショック、自己免疫疾患などさまざまな病気の原因となる。
それに対し、生体には炎症をコントロールする機構が備わっている。その中に、炎症を促進させるタンパク質Arid5aと、炎症を抑制させるタンパク質「Regnase-1」がある。Arid5aはIL-6などのmRNAに結合しRNAを安定化させ、Regnase-1はmRNAの分解を行う。これまで、未刺激や炎症応答時におけるArid5aの作用については不明な点があった。
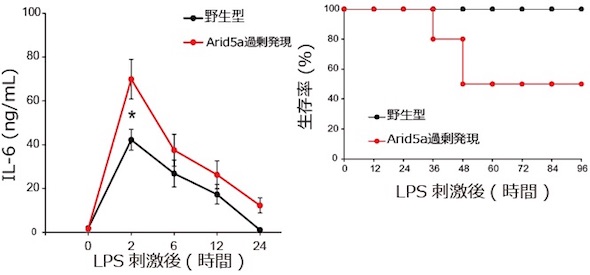
同研究では、まず、Arid5a過剰発現マウスを作製。IL-6が過剰に産生され、炎症性疾患を誘発すると考えられたが、健常時にはIL-6の産生への影響は確認されなかった。それに対し、炎症応答によってよりIL-6が産生され、敗血症性ショックが悪化し、Arid5aは刺激依存的に機能を発揮することが分かった。
次に、RAW264.7細胞において、未刺激状態ではArid5aは主に核内に局在し、Regnase-1は細胞質に局在していることを確認。また、Arid5aが核の中に移行する制御機構を解析したところ、Importin-α/β1経路を介していると示唆された。
炎症応答後のArid5aの核―細胞質間の変化を調べたところ、核内のArid5aは減少し、細胞質内のArid5aは増加していた。核外輸送因子CRM1の特異的阻害剤であるレプトマイシンBを加えると、刺激後に起こるArid5aの核外移行が阻害され、IL-6の産生が減少した。
以上から、Arid5aはImportin-α/β1経路を介して核内に移行し、その後、炎症応答により、CRM1経路を介して核外に移行することが明らかになった。未刺激状態では不必要なIL-6の産生は抑えられているが、IL-6は免疫を活性化するために必要なものだ。炎症応答後、Arid5aはIl6 mRNAと核内で結合し、分解機構を阻害するために細胞質に移行すると考えられる。つまり、Arid5aの細胞質移行が炎症を促進するために重要だということが示唆された。
同研究は、過剰な、もしくは慢性の炎症で生じる疾患の病態解明の手掛かりになる。また、Arid5aの核外移行を阻害することで、IL-6を減少させ、敗血症性ショックや自己免疫疾患を抑えるという新しい治療法の開発につながると期待される。
関連記事
 筋ジストロフィーの原因が明らかに、分泌型生理活性物質を狙った治療へ
筋ジストロフィーの原因が明らかに、分泌型生理活性物質を狙った治療へ
大阪大学は、成人の筋ジストロフィーで最も多い筋強直性ジストロフィーの骨格筋障害の原因が、分泌型生理活性物質「インターロイキン6」の産生異常にあることを解明した。 心筋炎の治癒過程で増殖する心筋細胞を発見、心臓の再生/修復への応用見込む
心筋炎の治癒過程で増殖する心筋細胞を発見、心臓の再生/修復への応用見込む
大阪大学は、増殖能を失うとされていた哺乳類成体の心筋細胞について、心筋炎が自然治癒する過程で心筋細胞が増殖することを明らかにした。このメカニズムをさらに検討すれば、心筋細胞を人為的に増殖させる技術開発につながるという。 ステロイドホルモンが免疫力を高めるメカニズム、昼と夜で反応に違い
ステロイドホルモンが免疫力を高めるメカニズム、昼と夜で反応に違い
京都大学は、ステロイドホルモンの1つであるグルココルチコイドが免疫力を高めるメカニズムを明らかにした。不規則な生活によるグルココルチコイドの分泌の乱れが、免疫力を低下させる可能性を示唆するものだ。 国産で初めて製造販売承認を取得した全人工手関節
国産で初めて製造販売承認を取得した全人工手関節
帝人ナカシマメディカルは、全人工手関節「DARTS人工手関節」を開発し、国産で初めて製造販売承認を取得した。掌側と腕側を完全に固定せず、前後に滑らかに動かせる。 痛みのシグナルを強めるタンパク質を発見
痛みのシグナルを強めるタンパク質を発見
大阪大学は、脊髄内の介在神経からネトリン4というタンパク質が分泌され、痛みを増幅させることを発見した。既存の薬では治療しきれない慢性疼痛に対する治療薬の開発につながることが期待される。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
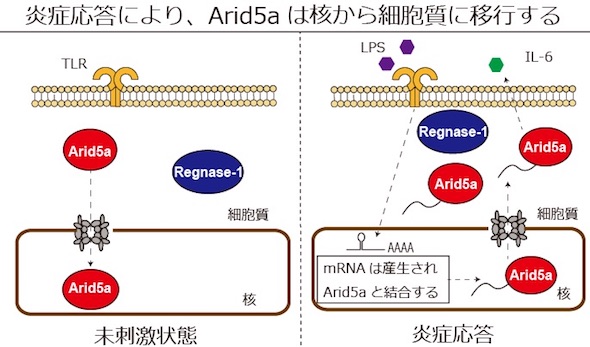
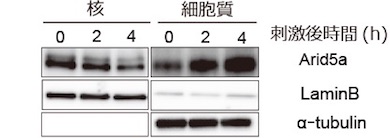 Arid5aはLPS刺激後に核内で減少し、細胞質で増加する 出典:大阪大学
Arid5aはLPS刺激後に核内で減少し、細胞質で増加する 出典:大阪大学


