砂糖が誘発する肥満を抑制するバイオマーカーを発見:医療技術ニュース
京都大学らは、ヒトの便検体を指標に、ヒト消化管常在細菌の一種であるStreptococcus salivariusが、スクロース誘発性肥満を抑制するバイオマーカーになることを発見した。
京都大学は2025年2月3日、ヒトの便検体を指標に、ヒト消化管常在細菌の一種であるStreptococcus salivarius(S. salivarius)が、スクロース(砂糖)誘発性肥満を抑制するバイオマーカーになることを発見したと発表した。肥満や糖尿病などの代謝性疾患の新たな予防や治療法につながることが期待される。東京農工大学との共同研究による成果だ。
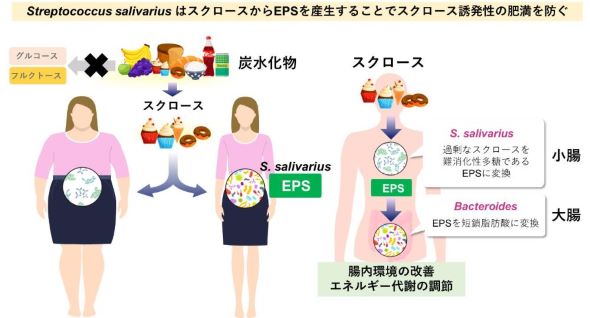
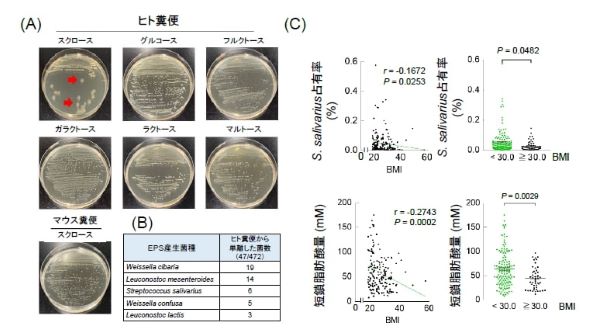
難消化性菌体外多糖(EPS)は、有益な植物繊維様物質として知られている。約500人のヒト健常者と肥満症患者の糞便を用いて、ヒト腸内細菌由来EPS産生菌を探索したところ、5菌種が同定された。そのうちS. salivariusが、マウス糞便からは検出されない一方でほとんどのヒト糞便から検出されることや、ヒト腸内S. salivariusの占有率と短鎖脂肪酸濃度がBMIと負の相関を示したことから着目した。
S. salivariusがスクロースを基質として産生するEPS(SsEPS)の構造解析により、SsEPSが宿主の酵素では消化できない植物繊維様物質である難消化性多糖であることが明らかとなった。
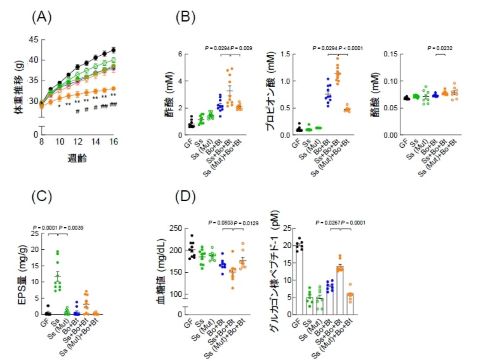
肥満モデルマウスを用いた実験では、SsEPSを長期間摂取したマウスでは対照群と比較して、体重増加が抑制され、宿主の腸内が変化しSsEPSを利用できるヒト腸内優先菌種と短鎖脂肪酸濃度の増加、血糖値など代謝パラメーターの改善が認められた。一方、短鎖脂肪酸を認識する受容体の欠損マウスでは、SsEPS摂取における効果が認められなかった。
これからの結果から、SsEPSにおける代謝機能の改善は、腸内細菌が産生する短鎖脂肪酸が関与していることが明らかとなった。
また、無菌マウスにSsEPS産生菌または非産生菌を移植しスクロースを長期的に摂取させると、SsEPS産生菌を移植したマウスは、非産生菌移植マウスよりも腸内でEPSを産生した。SsEPS産生菌と資化菌を移植すると、スクロース誘発性の肥満誘導における体重増加の抑制、糞便中の短鎖脂肪酸濃度の増加、血糖値などの代謝パラメーターの改善が認められた。
これらの結果から、S. salivariusが摂取した炭水化物中の過剰なスクロースを腸内でEPSに変換することで、宿主の吸収を抑えるだけでなく、腸内環境を改善して、スクロース誘発性肥満を防いでいることが明らかとなった。
関連記事
 人工細胞内に細胞核を模倣した区画を再現することに成功
人工細胞内に細胞核を模倣した区画を再現することに成功
東京大学は、人工細胞中に細胞核に相当する区画構造を構築し、遺伝情報の転写とタンパク質合成を空間的に分離して再現することに成功した。生命システムの理解や、効率的なタンパク質合成などへの応用が期待される。 正式発効する欧州保健データスペース「EHDS」で医療機器メーカーが果たす役割
正式発効する欧州保健データスペース「EHDS」で医療機器メーカーが果たす役割
本連載第70回から欧州連合(EU)の欧州保健データスペース(EHDS)構想を取り上げてきたが、ようやく正式に発効することが決まった。 大阪・関西万博に、音や映像だけでなく触覚や振動を送り合える装置を設置
大阪・関西万博に、音や映像だけでなく触覚や振動を送り合える装置を設置
NTTらは、2025年日本国際博覧会「大阪・関西万博」において、「ふれあう伝話」の設置を決定した。ふれあう伝話は、IOWNを活用して音や映像だけでなく、触覚や振動を送り合える装置だ。 飲み込みやすい錠剤の開発を目指した共同研究を開始
飲み込みやすい錠剤の開発を目指した共同研究を開始
第一三共ヘルスケアと藤田医科大学は、錠剤の服用シミュレーションの共同研究に関する契約を締結した。加齢に伴う嚥下力の低下に着目し、高齢者を含む全ての人が服用しやすい錠剤の開発に取り組む。 複数の治療標的タンパク質に作用する化合物を設計する創薬AIを開発
複数の治療標的タンパク質に作用する化合物を設計する創薬AIを開発
名古屋大学は、同時に複数の治療標的タンパク質に作用する、新薬候補化合物の化学構造を設計する創薬AIを開発した。応用例では、気管支ぜんそくの2つの治療標的タンパク質に作用するAIを設計し、化合物を合成した。 医療AIはクラウドベースへ、オリンパスが消化器系内視鏡でプラットフォームを構築
医療AIはクラウドベースへ、オリンパスが消化器系内視鏡でプラットフォームを構築
消化器系内視鏡で世界トップシェアのオリンパスがAI技術の導入を積極的に進めている。2023年6月にオリンパス傘下に加わったOdin Vision CEO兼ディレクターのピーター・マウントニー氏に、同社の技術やオリンパスグループが目指す消化器系内視鏡向けAI技術の開発の方向性などについて聞いた。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
コーナーリンク