がんになりにくい長寿ハダカデバネズミからiPS細胞の作製に成功:医療技術ニュース
北海道大学は、長寿命でがんになりにくい体質のハダカデバネズミからiPS細胞を作製することに成功し、その腫瘍化耐性メカニズムを解明した。将来、人間にも応用できるがん化抑制法の開発やがん予防に役立つことが期待される。
北海道大学は2016年5月11日、長寿命でがんになりにくい体質のハダカデバネズミから、iPS細胞を作製することに成功したと発表した。同大学遺伝子病制御研究所の三浦恭子講師と慶應義塾大学医学部の岡野栄之教授らの共同研究グループによるもので、成果は同月10日に英科学誌「Nature Communications」オンライン版で公開された。
ハダカデバネズミはアフリカに生息する小型げっ歯類で、マウスと同等の大きさだが、生存期間は約10倍(約30年)と長寿命だ。がん化や低酸素環境に対する耐性があるため、研究対象として注目されている。
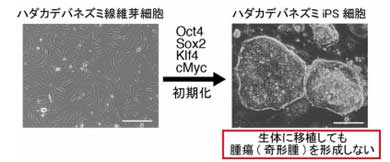
同研究グループは、ハダカデバネズミの皮膚から線維芽細胞を作製し、マウスやヒトと同じ方法でハダカデバネズミiPS細胞を作製。マウスやヒトのiPS細胞は、神経や心筋などに分化させずに生体に移植すると腫瘍(奇形腫)を形成するが、ハダカデバネズミiPS細胞では、未分化な状態で移植しても腫瘍を形成せず、腫瘍化耐性を持つことが分かった。
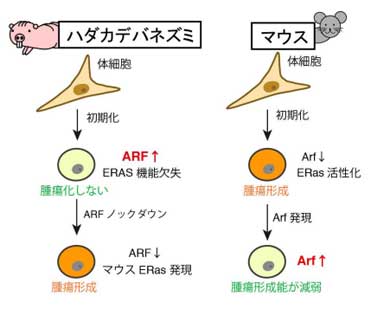
次に、このiPS細胞の腫瘍化耐性メカニズムを解析したところ、代表的ながん抑制遺伝子であるINK4aの発現は抑制されたが、同じがん抑制遺伝子のARFの発現は活性化状態が保たれていた。また、マウスES細胞のみに発現するがん遺伝子ERASの配列を解析すると、ハダカデバネズミのERASには他の動物にはない4塩基の挿入が存在し、ERASタンパクの機能不全をもたらす遺伝子変異が生じていた。
そこで、ARFを人工的に抑制し、機能不全のERASの代わりにマウスのERasを導入すると、腫瘍形成能を獲
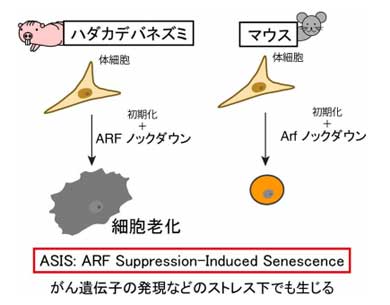
得し、生体移植後に奇形腫を形成した。このことから、ハダカデバネズミiPS細胞の腫瘍化耐性は、ARFの活性化とERASの機能欠失によるものと考えられる。さらに、ストレスで活性化したARFを抑制した場合、細胞の増殖が止まり、がん抑制機構の1つである「細胞老化」の状態になることが判明。ハダカデバネズミでは、ARFの活性化だけでなく、ARFが抑制された状況でもがん抑制機構が機能し、二重の防御機構で初期化やがん化を防ぐことが分かった。
この腫瘍化耐性メカニズムを応用することで、より安全なヒトiPS細胞の作製につながる可能性があるという。将来は、人間にも応用できる新たながん化抑制方法の開発やがん予防にも役立つことが期待される。
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
- 血液検査で認知症の予兆をキャッチする技術を開発
- 「週1回のチーズ」で認知症リスクが低下、明治らが1万人超の追跡調査で解明
- 浴室ぬめりや生乾き臭を1時間で撃退、負イオンがオゾンの酸化作用に作用
- 連邦政府封鎖明けからAI駆動型デジタルヘルス活用が急加速する米国の医療DX
- ゼブラフィッシュ胚でノロウイルスの人工合成に成功
関連記事
 日立と北大が共同開発の陽子線治療システム、医療機器の製造販売承認を取得
日立と北大が共同開発の陽子線治療システム、医療機器の製造販売承認を取得
北大の動体追跡照射技術と日立のスポットスキャニング照射技術を組み合わせることで、呼吸などで位置が変動する腫瘍でも、高精度な陽子線の照射が可能だ。 ロボット使うと思うだろ? これ、ゴムなんだぜ――“軽労化”を狙うスマートスーツ
ロボット使うと思うだろ? これ、ゴムなんだぜ――“軽労化”を狙うスマートスーツ
大学の研究成果の紹介と企業とのビジネスマッチングを行う展示会「イノベーション・ジャパン2014−大学見本市」では、数多くの大学発の研究成果が発表された。同イベントでスマートサポートは、製造業の現場業務などの負担を軽減する「スマートスーツ」を出展し「軽労化」を訴えた。 【ESEC2012】「次はこれが来る!!」――家電や身近なサービスへの応用が期待される注目技術
【ESEC2012】「次はこれが来る!!」――家電や身近なサービスへの応用が期待される注目技術
2012年5月9〜11日の3日間、東京ビッグサイトで「第15回 組込みシステム開発技術展(ESEC2012)」が開催された。本稿では、近々家電製品に搭載されるとみられる最先端技術や、身近に触れる機会のありそうな最新ソリューションなどを多数の写真を交えて紹介する。 「どうせ無理」をやめよう――ロケット開発する町工場・植松電機
「どうせ無理」をやめよう――ロケット開発する町工場・植松電機
「ロケットなんて普通は作れない」というのは思い込み。「どうせ無理」と言わずにどうしたらできるか考えてみよう。 燃料電池の性能と生産性を10倍に、5カ年研究プロジェクトが始動
燃料電池の性能と生産性を10倍に、5カ年研究プロジェクトが始動
新エネルギー・産業技術総合開発機構(NEDO)は、燃料電池車の本格的な普及に向けた5カ年の研究開発プロジェクトを新たに始める。燃料電池スタックの性能と生産性を現在の10倍にするための技術確立が目標となっている。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク
 ハダカデバネズミ
ハダカデバネズミ