流体せん断力による微絨毛形成の発見とその分子メカニズムの解明:医療技術ニュース
東京大学は、ヒト胎盤バリアを構成する胎盤絨毛上皮細胞(胎盤バリア細胞)は、流体せん断力に応答して微絨毛を形成することを発見した。流体せん断力は、タンパク質局在の変化を介して細胞機能も変化させることが明らかになった。
東京大学は2015年11月10日、ヒト胎盤バリアを構成する胎盤絨毛上皮細胞(胎盤バリア細胞)は、流体せん断力に応答して微絨毛を形成することを発見したと発表した。これは、同大学生産技術研究所の竹内昌治教授と三浦重徳特任研究員(研究当時)らの研究グループによるもので、成果は同年11月13日に、英科学誌「Nature Communications」で公開された。
母体血中にある酸素や栄養物は、胎盤バリアと呼ばれる胎盤内のバリア構造を通って、胎児の血液へと輸送される。母体血側の透過バリアを構成する胎盤バリア細胞は、胎盤へと旺盛に流れ込む母体血から常に流体せん断力(流体によって物体が滑り切られるような作用を与える力)を受けている。しかし、これまでの胎盤バリアの研究は、シャーレの上に細胞を静置培養した状態でなされており、細胞形態や機能が流れによってどのような影響を受けているのかは、ほとんど研究されてこなかった。
近年、生体組織構造や機能の一部をマイクロ流路内で再構築した「Organ-on-chip」研究が盛んになっている。MEMS(Micro Electro Mechanical Systems)技術や液体工学を利用し、力学刺激が細胞や組織構造物に及ぼす影響を、分子レベルで解析することができるようになった。同研究グループは、MEMS技術を利用して、ヒト胎盤バリア構造をマイクロ流路内に再構成したデバイス(Organ-on-chip)を作製。このデバイスを用いて、母体血流によって生じる流体せん断力がバリアを構成する細胞の形態や機能にどのような影響を与えるかを調べた。
結果、微絨毛と呼ばれる細胞突起構造が、静置培養を行った細胞ではほとんど観察されなかったのに対し、灌流培養では胎盤バリア細胞の細胞表面に形成されることを見いだした。流体せん断力の負荷に応じて、微絨毛の数や長さが変化していることも分かった。
また、灌流培養で誘導された微絨毛には、生体内と同様に胎盤バリアのグルコース輸送に関わるタンパク質GLUT1が絨毛上皮細胞の頂端部に局在することが認められ、これに伴ってグルコースの輸送量も増加することが分かった。静置培養では、生体組織とは異なりGLUT1は主に細胞内に局在し、グルコースの輸送量も少なかった。以上の結果から、流体せん断力は細胞の形態だけでなく、タンパク質局在の変化を介して細胞機能も変化させることが明らかとなった。
さらに、分子生物学的に解析した結果、TRPV6(Transient Receptor Potential, Vanilloid family type 6)と呼ばれる、細胞外のカルシウムを内部に取り込むカルシウムイオンチャネルが流体せん断力により活性化され、その下流の細胞内シグナル伝達分子が働くことで微絨毛形成が誘導されていることが分かった。
微絨毛はさまざまな細胞種で発達しており、多様な細胞・組織機能の発現に関与している。微絨毛を介した力学刺激応答機構を分子レベルで制御することができれば、さまざまな組織機能を改善する治療薬の開発へとつながる。今後、この研究で見いだされた力学応答機構が胎盤バリア細胞以外の細胞種で広く働いているのか、生体内においてどのような役割を果たしているのかを調べていく必要があるという。
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
関連記事
 運転能力を低下させる白質病変、東京大学らが実車実験で確認
運転能力を低下させる白質病変、東京大学らが実車実験で確認
東京大学と高知工科大学は、医学的に症状のない軽度の大脳白質病変(以下、白質病変)と診断された高齢の運転者は、そうでない高齢の運転者に比べて、運転能力が低下していることが実車実験で確認できた、と発表した。 心臓を“設計”する! 東大の人工心臓研究に「PTC Creo」が採用
心臓を“設計”する! 東大の人工心臓研究に「PTC Creo」が採用
PTCジャパンは、東京大学大学院医学系研究科の研究グループが完全置換型人工心臓の開発に同社の3次元CAD「PTC Creo」を活用していることを明らかにした。 「超小型衛星の世界を変える!!」――世界最小クラスのイオンエンジン「MIPS」
「超小型衛星の世界を変える!!」――世界最小クラスのイオンエンジン「MIPS」
東京大学 先端科学技術研究センターの小泉宏之准教授と次世代宇宙システム技術研究組合(NESTRA)が共同開発している世界最小クラスのイオンエンジン「MIPS」。このMIPSとは一体どのようなエンジンなのか、これにより超小型衛星の世界がどのように変わるのか。開発者に聞く。 欧米発CAEはとにかく高い! ――設計者CAEのあるべき姿とライセンス費用の問題
欧米発CAEはとにかく高い! ――設計者CAEのあるべき姿とライセンス費用の問題
設計者自身によるCAEの浸透・発展を阻んでいるのは、CAEソフトの煩雑になりがちなオペレーション(使い勝手の問題)や、ライセンス費や教育費など「CAEの運用コスト」。――日本機械学会 設計工学・システム部門による講習会で、企業や教育現場におけるCAE導入の課題提示や、ライセンス費の問題提起が行われた。 東大主催ハッカソン「JPHACKS」に3D技術を体感できるWebサービスAPIを提供、オートデスク
東大主催ハッカソン「JPHACKS」に3D技術を体感できるWebサービスAPIを提供、オートデスク
オートデスクは、東京大学本郷キャンパスで開催される国内最大規模の学生向けハッカソン「JPHACKS」(会期:2014年12月13〜14日)に協賛。参加者に対し、同社のWebサービスAPIを提供すると発表した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 自宅での「尿検査」がより正確に、小型二電極バイオセンサーを開発
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
コーナーリンク
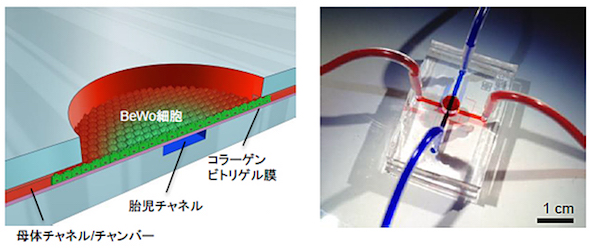 ヒト胎盤バリア構造を再構成した「Organ-on-chip」デバイス
ヒト胎盤バリア構造を再構成した「Organ-on-chip」デバイス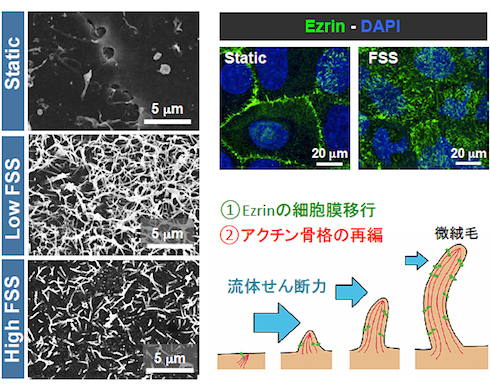 流体せん断力(FSS)による微絨毛形成の様子(Static:静置培養)
流体せん断力(FSS)による微絨毛形成の様子(Static:静置培養)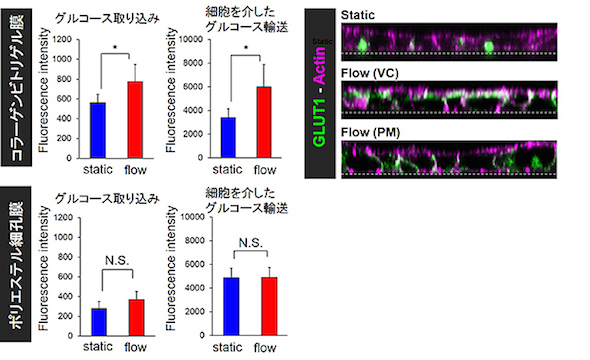 流体せん断力によるGLUT1の細胞頂端膜への局在
流体せん断力によるGLUT1の細胞頂端膜への局在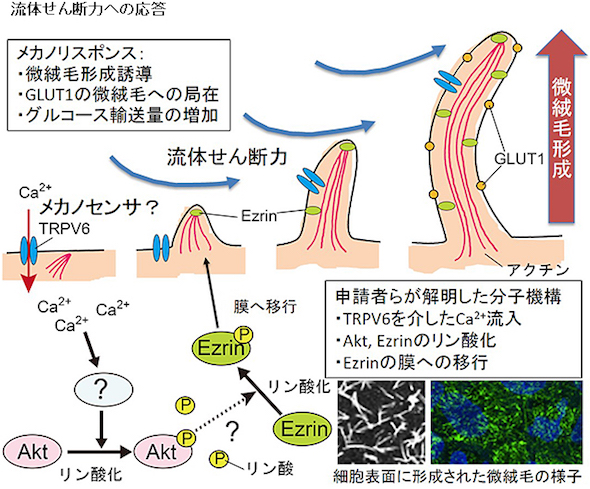 胎盤上皮バリア細胞における流体せん断力誘導性微絨毛形成の概要
胎盤上皮バリア細胞における流体せん断力誘導性微絨毛形成の概要


