新型コロナからアルツハイマー病の神経細胞死を抑制するペプチドを開発:医療技術ニュース
東京都立大学は、新型コロナウイルスのタンパク質Orf9bが、アルツハイマー病関連キナーゼMARK4の活性を非競合的に阻害することを発見した。また、Orf9bの配列から、細胞透過性MAPK4阻害ペプチドを開発した。
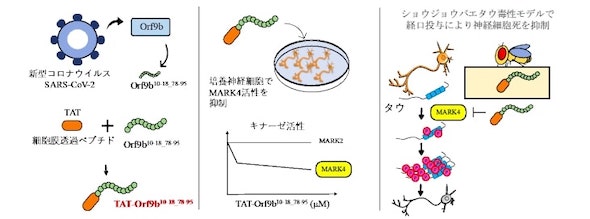
東京都立大学は2023年11月13日、新型コロナウイルスのタンパク質Orf9bが、アルツハイマー病関連キナーゼMARK4(微小管親和性調節キナーゼ4)の活性を非競合的に阻害することを発見したと発表した。Orf9bの配列から、細胞透過性MAPK4阻害ペプチドTAT-Orf9b10-18_78-95を開発した。
アルツハイマー病では、微小管結合タンパク質タウが脳に蓄積し、神経細胞死を引き起こす。疾患脳においてタウは、過剰にリン酸化されることで凝集、蓄積するが、このリン酸化にMAPK4の関与が示唆されている。
今回の研究では、Orf9bがMARKファミリーと相互作用することから、Orf9bの配列からMARK4を阻害するペプチドを開発。哺乳類培養細胞にOrf9bを発現させ、タウのリン酸化を指標にMARK4活性の影響を調べたところ、タウのリン酸化が阻害されることが分かった。
Orf9bは全長97アミノ酸で、これを人工合成するために、MAPK4の阻害に必要な最小限の領域を探索した。その結果、Orf9bの10〜18番目と78〜95番目のアミノ酸をつないだペプチドOrf9b10-18_78-95を合成すると、MARK4の活性阻害に十分であることが分かった。
MARK4の活性阻害パターンを見ると、Orf9b10-18_78-95は濃度非依存的に阻害していた。このことから、MAPK4の基質認識部位とは異なる領域に結合して立体構造を変化させる、アロステリック阻害であることが示された。
アロステリック阻害剤は、一般的に競合阻害剤よりも特異性が高い。実際にOrf9b10-18_78-95は、MAPK2の活性は阻害せず、MAPK4に対する特異性が高かった。
細胞外から加えることを想定し、TAT(細胞膜透過ペプチド)を付加したTAT-Orf9b10-18_78-95を作成。培養神経細胞に取り込まれ、MAPK4によるタウのリン酸化を阻害することを確認した。ヒトのタウを発現するショウジョウバエに経口投与すると、TAT-Orf9b10-18_78-95は脳内に取り込まれ、タウによる神経細胞死が抑制された。
MAPK4阻害は、アルツハイマー病の治療戦略として注目されている。今後、MAPK4を標的とした、アルツハイマー病の治療法開発につながることが期待される。
- ウシ由来の組織再生型靱帯で膝を切らずに再建、2028年実装目指す
- 血液凝固を約5分に短縮する真空採血管を発売、検査を迅速化
- 子どもの顎発育をサポートする拡大装置を開発、矯正中でも違和感なく
- コンタクトをつけるだけで眼圧を測定、緑内障の早期発見へ
- CT画像上で脳脊髄液腔を抽出する診断支援AI技術を開発
- ロレアルが光技術を応用した赤外線ヘアアイロンとLEDマスクを発表
- のみ込む音をセンサーとAIで検知、高齢者の窒息防止へ
- アステラス製薬がヒト型ロボットによる細胞培養の自動化に向け、技術指定を取得
- 汗中乳酸をモニタリングするウェアラブルデバイスを開発
- パーキンソン病などの集束超音波治療がMRIと併用可能に
関連記事
 カテキンとフッ化物の相乗作用でむし歯予防効果が向上
カテキンとフッ化物の相乗作用でむし歯予防効果が向上
東北大学は、カテキンとフッ化物を併用することで、口腔内微生物による酸の産生を効率良く抑制できることを明らかにした。カテキンとフッ化物の相乗作用を利用した、新しいむし歯予防法の開発が期待される。 生体の撮影も可能な、動的条件下でのX線CT撮影技術を開発
生体の撮影も可能な、動的条件下でのX線CT撮影技術を開発
早稲田大学は、ストロボ効果を利用した動的条件下でのX線CT撮影技術を開発した。心臓のように繰り返し変形するものであれば、生体の動的X線撮影も可能になる技術だ。 残存しているわずかな筋の動作でメタバースに操作命令できる技術を開発
残存しているわずかな筋の動作でメタバースに操作命令できる技術を開発
NTTは、四肢など肢体が重度に不自由な人のわずかな筋の動作をメタバースへの操作命令につなげる入力インタフェースを開発した。自分の意思を伝えるための身体拡張技術として、表面筋電信号入力を利用できるようになる。 医療機関向けにIoMT一元管理支援サービスの提供を開始
医療機関向けにIoMT一元管理支援サービスの提供を開始
富士フイルムビジネスイノベーションは、医療機関向けに「IT Expert Services IoMTデバイスマネジメントサービス」の提供を開始した。医療機関内のIT機器を可視化し、セキュリティリスクを一元管理する。 紫外線や熱が皮膚のバリア機能を低下させる一因を解明
紫外線や熱が皮膚のバリア機能を低下させる一因を解明
富士フイルムは、紫外線や熱で酸化した皮脂である過酸化脂質と分解物が、皮膚のバリア機能を低下させる一因を解明した。セラミドなどの産生に重要な遺伝子や、バリア機能維持関連因子の遺伝子発現量を減少させる。 造影剤を使わないCT画像から膵臓がんの検出を支援する技術を開発
造影剤を使わないCT画像から膵臓がんの検出を支援する技術を開発
富士フイルムと神戸大学は、AI技術を活用して、非造影CT画像から膵臓がんが疑われる所見の検出を支援する技術を開発した。人間ドックなどでの活用により、膵臓がんの早期発見につながることが期待される。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク