カスケード反応を利用してがん組織特異的に結合するα線治療分子を開発:医療技術ニュース
理化学研究所らは、がん細胞が産生する分子と反応してカスケード反応を引き起こす化合物を導入した標的α線治療分子を設計し、がん組織のみに結合させて生体内部からの放射線がん治療をする技術を開発した。
理化学研究所と東京工業大学は2023年6月27日、がん細胞が産生する分子と反応してカスケード反応を引き起こす化合物を導入した標的α線治療分子を設計し、治療分子を体内のがん組織のみに結合させ、生体内部からの放射線照射でがんを治療する技術を開発したと発表した。
研究チームが利用した化学反応は、がん細胞内で特異的かつ大量に産生するアクロレインと、窒素3分子からなるアジド基を持つフェニルアジドという化合物が選択的に起こす還化付加から始まるカスケード反応だ。
治療核種にはアスタチン-211(211At)を用い、211Atとフェニルアジドを結合させた治療分子「211At-radiolabeled 2,6-diisopropylphenylazide(ADIPA)」を作製した。なお、低濃度でも反応が進むように、ADIPAではフェニルアジドの代わりにアクロレインに対する反応性が高い2,6-ジイソプロピルフェニルアジドが用いられている。
ADIPAががん細胞内に取り込まれると、アジド基とアクロレインとの還化付加から始まるカスケード反応が起こり、中間体を経て窒素2分子からなるジアゾ基を持つジアゾ化合物に変化する。ジアゾ化合物は速やかに細胞小器官(オルガネラ)と共有結合を形成する。
このようにしてADIPAはがん細胞特異的に結合し、211Atから放出されるα線により周辺のがん細胞を死滅させる。一方、α線は飛距離が短いため、少し離れた位置の正常細胞には影響を及ぼさない。
ヒトの肺がん細胞を移植したモデルマウスを用いてADIPAの治療効果を調べたところ、211Atをそのまま腫瘍内に直接注射した群と、溶媒のみ(ビーグル)を投与した群では腫瘍の成長速度に差はなかったが、ADIPAを投与した群では腫瘍の成長が抑制され、生存期間が延長した。ADIPAによる治療効果は、腫瘍内への直接注射だけでなく静脈注射でもみられた。また、ADIPAの投与量は、211Atをそのまま投与した場合の約3分の1に抑えられた。
解剖により、投与したADIPAの多くががん細胞に蓄積していることが確認されている。また治療期間中、全群が体重を維持し、副作用も生じなかった。
211Atは標的α線治療で一般的に使用されている核種で、大量かつ高純度に製造する方法が開発されている。
関連記事
 ショックの原因を診断する簡易超音波検査の有用性を確認
ショックの原因を診断する簡易超音波検査の有用性を確認
横浜市立大学は、ショックの原因をベッドサイドで診断するポイントオブケア超音波検査の診断精度について、その有用性を明らかにした。 人工血管とステントグラフトを融合、胸部大動脈疾患の治療をより低侵襲に
人工血管とステントグラフトを融合、胸部大動脈疾患の治療をより低侵襲に
テルモは、胸部大動脈疾患の治療で使用する、人工血管とステントグラフトを組み合わせたハイブリッド型の製品であるフローズンエレファントトランク「Thoraflex Hybrid」の国内販売を開始する。 痛みを抑制する新しい調節機構を発見
痛みを抑制する新しい調節機構を発見
京都大学は、ショウジョウバエ幼虫の逃避行動をモデルに、ゲノムワイド関連解析を実施し、痛みによる逃避行動を抑制する遺伝子を発見した。 医療用装着型サイボーグの小型モデル、医療機器承認を申請
医療用装着型サイボーグの小型モデル、医療機器承認を申請
CYBERDYNEは、小柄な患者が使用できる小型の医療用HAL下肢タイプについて、日本における医療機器承認を申請した。適用疾患は、既承認の医療用HALと同様の、神経筋難病8疾患および脊髄疾患2疾患だ。 紫外線照射ロボットによる除菌システムの製品化を目指して業務提携
紫外線照射ロボットによる除菌システムの製品化を目指して業務提携
島津製作所は、Shyld AIと技術提携契約を締結した。人が立ち入った範囲を紫外線照射ロボットが効率的に除菌するシステム「UVシュート」の製品化を目指す。 イヌに投与可能な人工血液を開発、ブタの血漿成分を利用
イヌに投与可能な人工血液を開発、ブタの血漿成分を利用
中央大学は、ブタの血漿成分を利用した「イヌ用人工血液」を開発した。POx-PSA溶液を凍結乾燥することで、粉末で1年以上保存できる。副作用を引き起こさない原理から、ネコへの投与も可能だと考えられる。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
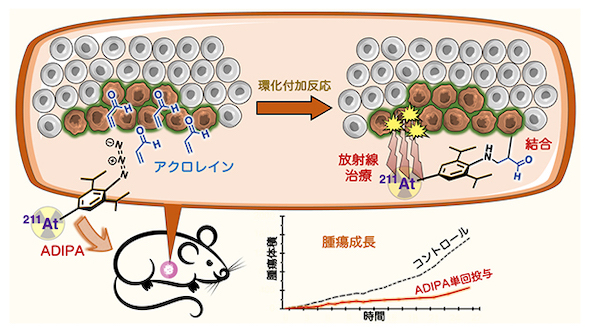 開発した放射性治療分子(ADIPA)の作用機序の概念図 出所:理化学研究所
開発した放射性治療分子(ADIPA)の作用機序の概念図 出所:理化学研究所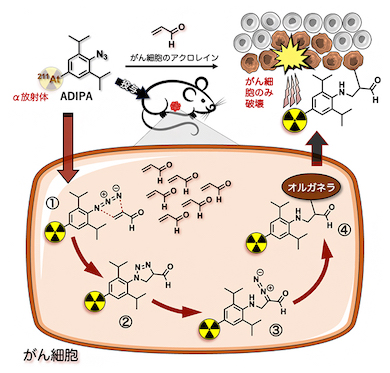 アジド基とアクロレインの環化付加から始まるカスケード反応によるADIPAの作用 出所:理化学研究所
アジド基とアクロレインの環化付加から始まるカスケード反応によるADIPAの作用 出所:理化学研究所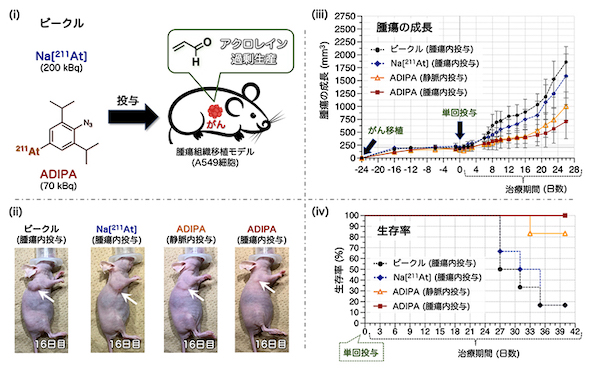 ヒト肺がん移植マウスへの薬剤投与によるがん治療試験 出所:理化学研究所
ヒト肺がん移植マウスへの薬剤投与によるがん治療試験 出所:理化学研究所


