科学的検証を経ない再生医療を治療として提供、再生医療法の構造的課題とは:医療技術ニュース
京都大学は、日本の再生医療法の下で安全性や有効性が疑われる治療法が提供されている実態を調査し、それが同法の構造的な問題に起因している可能性があることを発表した。
京都大学は2022年9月2日、日本の再生医療等安全性確保法(再生医療法)の下で安全性や有効性が疑われる(幹)細胞治療が提供されている実態を調査し、それが同法の構造的な問題に起因している可能性があることを発表した。
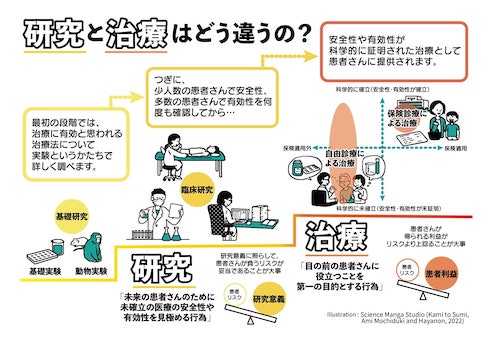
本来、治療は研究によって安全性や有効性が科学的に証明された上で、患者に提供される。しかし、日本では自由診療であれば、安全性や有効性が十分に証明されていない治療でも提供できる。
再生医療法は2017年に一部改正され、厚生労働省のWebサイトに「再生医療等を受ける者に対する説明文書及び同意文書」を公開することが義務付けられている。今回の研究では、この文書を元に、現在提供されている(幹)細胞治療について国内の状況を正確に把握すべく、調査、分析した。
その結果、2377の医療機関で3467件の(幹)細胞治療が提供可能になっていた。それらの治療法の中には、培養した(幹)細胞を患者に投与する治療などISSCR(国際幹細胞学会)のガイドラインで認めていない治療法や、科学的エビデンスが確立していないがん免疫療法が多数含まれていた。
このような状況が発生している要因として、研究グループは再生医療法の構造的な課題を指摘している。研究から治療が実用化されるまでの過程において、「研究で安全性と有効性が証明された医療が治療になること」「研究と治療の定義とその区別」「『新規性の高い未確立医療技術』と『未検証の治療』の区別」は重要な基本的概念だ。しかし、再生医療法ではこの3つの基本的概念が明確に区別されていない。
この状況について研究グループは、科学的エビデンスが確立していない治療が患者に提供されていることにつながる可能性があるとしている。また今後、再生医療法が改正される際は、3つの基本的概念を明確にし、医療機関や医師と認定再生医療等委員会などとの間で、内容を共有できるようにすることが望ましいとしている。
日本では2014年に再生医療法が制定され、細胞を治療として人に投与する場合は、自由診療でも提供計画について専門委員会の承認を受けたり、厚生労働省に提出したりする必要がある。しかし、安全性や有効性が明確でない(幹)細胞治療を禁じているわけではない。これまでの実態調査は、こうした治療法を法律で禁じている国や英語圏からの報告がほとんどだった。
研究グループは今後、再生医療に対する認識や誤解について明らかにするため、アンケート調査の実施や、医療と法規制の課題についての検討を進めていく。
関連記事
 オキシトシンの見える化に成功、脳内の挙動に影響しない極小タグを開発
オキシトシンの見える化に成功、脳内の挙動に影響しない極小タグを開発
慶應義塾大学と横浜国立大学は、オキシトシンにタグとしてアルキンを付加したアルキンオキシトシンを開発し、オキシトシンの見える化に成功した。脳内におけるオキシトシンの作用部位や時空的動態を初めて観察した。 ストレスで皮膚から放出されるガスを識別するセンサーアレイを開発
ストレスで皮膚から放出されるガスを識別するセンサーアレイを開発
産業技術総合研究所は、酸化スズナノシートとMLの一種であるPCAを活用して、緊張によるストレスで皮膚から発生するストレスガスを識別するセンサーアレイを開発した。 治療計画プログラム付随の脳動脈瘤コイル留置用ステントが薬事承認
治療計画プログラム付随の脳動脈瘤コイル留置用ステントが薬事承認
アルムとPENTASが開発した、脳動脈瘤コイル留置用ステントと治療計画プログラムの医療機器製造販売が承認された。治療計画プログラムが付随した脳動脈瘤コイル留置用ステントの薬事承認は日本初だ。 ベトナムの医療用カテーテル新工場が完成、グローバルな需要拡大に対応
ベトナムの医療用カテーテル新工場が完成、グローバルな需要拡大に対応
カネカは、医療用カテーテルを生産する、カネカメディカルベトナムの新工場が2022年8月に完工したと発表した。医療用カテーテルの生産能力を増強し、世界的な需要拡大に対応する。 睡眠状態から個別アドバイスを提示する睡眠改善プログラムを開発
睡眠状態から個別アドバイスを提示する睡眠改善プログラムを開発
パラマウントベッドは、睡眠状態を把握し、角度が自動で変化する電動ベッド「Active Sleep BED」の専用アプリ向け「睡眠改善プログラム」を開発した。個別アドバイスを提示し、行動変容を促す。 アンドロイドの顔の表現を厳密に評価する新手法を開発
アンドロイドの顔の表現を厳密に評価する新手法を開発
大阪大学は、アンドロイドロボットの顔の表現性能を厳密に評価する、新しい手法を発表した。皮膚の各部が運動し得る空間範囲を「顔の表現力」の数値指標として採用している。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク