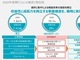
効果が長期間持続する、筋ジストロフィーのゲノム編集治療に成功:医療技術ニュース
京都大学iPS細胞研究所は、ゲノム編集治療に利用できる脂質ナノ粒子輸送システムを開発し、筋ジストロフィーモデルマウスのゲノム編集に成功した。効果が長期間持続し、かつ繰り返し投与できるため、骨格筋疾患の新しい治療法として期待できる。
京都大学iPS細胞研究所(CiRA)は2021年12月8日、ゲノム編集治療に利用できる脂質ナノ粒子(LNP)輸送システムを開発し、筋ジストロフィーモデルマウスのゲノム編集に成功したと発表した。武田薬品工業との共同研究プログラム「T-CiRA」による成果だ。
デュシェンヌ型筋ジストロフィーは、遺伝子の一部に変異が起こり、ジストロフィンタンパク質が作れずに発症する筋疾患難病だ。その治療法として、ジストロフィンタンパク質を作れるようにする、ゲノム編集治療が期待されている。
ただし、病態は骨格筋の広範に及ぶため、1回の投与ではゲノム編集薬剤が行き渡らず、複数回の投与が必要となる。しかし、従来のアデノ随伴ウイルス(AAV)ベクターによる遺伝子導入法では中和抗体ができてしまい、繰り返しの遺伝子導入が困難だった。
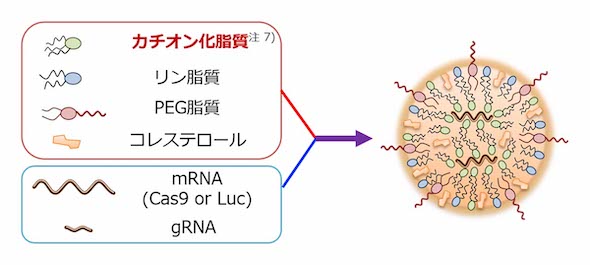
研究チームは今回、LNPを利用して、ゲノム編集に必要な酵素CRISPR-Cas9を広範囲の筋肉組織へ運搬する方法を開発した。
まず、mRNAを効率的に送達できるLNP組成を探索した。ここで見出したLNPにCas9 mRNAとガイドRNAを搭載し(LNP-CRISPR)、マウスの骨格筋で効率良くゲノム編集が起こることを確認した。
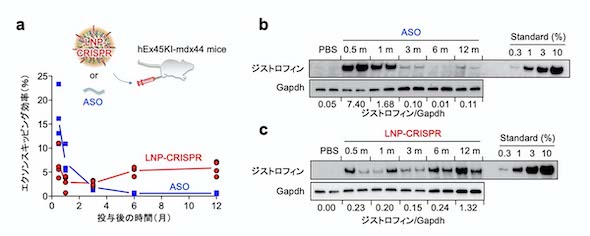
筋ジストロフィーモデルマウスにLNP-CRISPRを1回投与したところ、ジストロフィンタンパク質の回復効果が12カ月間、持続することを確認した。従来のジストロフィン遺伝子のmRNAに作用する核酸医薬の投与では、効果は1カ月間しか続かなかった。
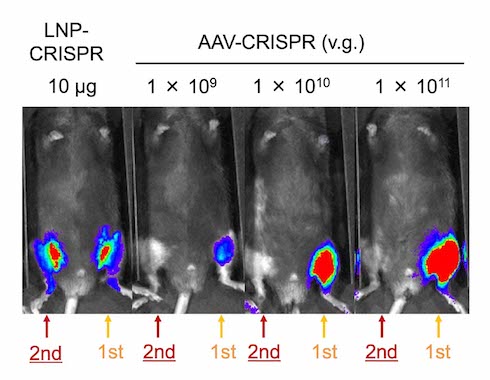
また、初回投与から28日後に再投与したところ、ゲノム編集活性を確認できた。さらに、2週間かけてLNP-CRISPRを6回投与した筋ジストロフィーモデルマウスでは、38.5%の筋繊維でジストロフィンタンパク質の発現が観察できた。このことから、LNP-CRISPRを繰り返し利用して、ゲノム編集を起こせることが分かった。
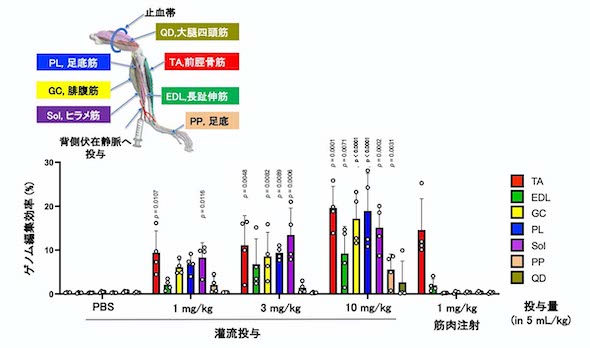
効率的に広範囲の筋肉へ薬剤を届ける方法を確認するため、ゲノム編集が及ぶ範囲を静脈からの灌流(かんりゅう)投与と筋肉注射で比較した。筋肉注射では注射した骨格筋のみでゲノム編集が起こったが、灌流投与では多くの筋肉でゲノム編集が起きていた。
筋ジストロフィーのゲノム編集では、骨格筋組織全体にゲノム編集酵素を行き渡らせる方法の開発が求められていた。効果が長期間持続し、繰り返し投与できる今回の技術は、骨格筋疾患の治療に利用できる新手法として期待できる。
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
関連記事
 デルタ株に特徴的な1つのアミノ酸変異がウイルスの病原性を増大させる
デルタ株に特徴的な1つのアミノ酸変異がウイルスの病原性を増大させる
国内の研究コンソーシアム「G2P-Japan」は、新型コロナウイルス「デルタ株」が従来株と比べて病原性が高いことを確認し、デルタ株に特徴的な変異P681Rが病原性の高さと関与していることを明らかにした。 「欧州NIS指令2」で注目される医療機器メーカーのCSIRT/PSIRTの役割
「欧州NIS指令2」で注目される医療機器メーカーのCSIRT/PSIRTの役割
本連載第33回で取り上げた「欧州NIS指令」だが、現在、改訂版の施行に向けた作業が急ピッチで進んでいる。 内視鏡用クラウドサービス向けの画像送信端末装置を発売
内視鏡用クラウドサービス向けの画像送信端末装置を発売
オリンパスとコニカミノルタは協業を開始し、オリンパスの内視鏡用クラウドサービス「Vivoly+」への画像送信端末装置として、コニカミノルタの医療用画像連携装置「BLUE Gate」を発売した。 薬包のIoT化により、薬の飲み忘れを防止するシステム
薬包のIoT化により、薬の飲み忘れを防止するシステム
MEDIOTOLOGYとデンソーウェーブは、薬包をIoT化することで、飲み忘れを防止するシステムを開発した。Apple製品と連携し、離れた場所から薬箱の中の状態をリアルタイムに確認できる。 全国規模でのサービス向上を目指し、医療機器のメンテナンス分野で業務提携
全国規模でのサービス向上を目指し、医療機器のメンテナンス分野で業務提携
GEヘルスケア・ジャパンとリコージャパンは、超音波診断装置および麻酔機器メンテナンス分野における業務提携を開始した。異なる強みを生かし、全国へのサービスエンジニア配置やサービス品質の向上を目的とする。 ネコは、姿が見えない飼い主の位置を飼い主の声から捉えている
ネコは、姿が見えない飼い主の位置を飼い主の声から捉えている
京都大学は、ヒトと住居を共にするネコは、視覚的には見えない飼い主の位置を飼い主の声から心の中で捉えており、その位置が瞬間的に変わると驚くことを明らかにした。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 医療および製薬DX市場は2035年に1.3兆円規模へ、AI創薬が急成長のけん引役に
コーナーリンク