光電効果を用いて、効率よくがん細胞死を誘導する放射線治療法を開発:医療技術ニュース
京都大学アイセムスは、がん細胞内に電子を発生させてDNAを効率よく切断し、細胞死を誘導する方法を開発した。アインシュタインが提唱した「光電効果」を利用するこの方法は、DNAに直接的に作用するため、放射線治療の効率向上が期待できる。
京都大学アイセムス(物質―細胞統合システム拠点)は2021年7月9日、がん細胞内に電子を発生させてDNAを効率よく切断し、細胞死を誘導する方法を開発したと発表した。
今回開発した手法は、アインシュタインが提唱した、金属原子などに光を当てると電子を放出する「光電効果」をがん細胞内で再現したものだ。光電効果が発生すると、原子内で連鎖反応が起こり、多数の電子が放出される。
ナノ粒子は、がん細胞に効率よく取り込まれ、細胞核の近くにとどまる特徴がある。そこで研究グループは、ヨウ素を含ませた、生体内で分解する多孔性シリカナノ粒子を合成。多細胞3次元モデルであるがんスフェロイドに、ナノ粒子を取り込ませてからX線照射をすると、DNAの二重鎖が切断され細胞死が起きることを確認した。
さらに、X線のエネルギーを変化させてDNAの二重鎖切断の影響を調べたところ、33.2keVで最も効果的に切断が生じることが明らかとなり、最適効果をもたらすためのX線のエネルギーを調整できることが示された。
がん治療における放射線治療は、細胞内分子のイオン化を引き起こすことで、DNAを切断してがん細胞の死を誘導する。従来の手法では、X線が直接DNAに作用することは少なく、細胞内の水分子がイオン化して発生する活性酸素によってDNAが切断される間接的な効果が多い。今回開発した方法はDNAのすぐそばで電子を発生させてDNAを切断するという直接的な効果を得られるため、酸素が少ないがんの中心部でも細胞死を誘導でき、放射線治療の効率向上が期待できる。
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
- 血液検査で認知症の予兆をキャッチする技術を開発
- 「週1回のチーズ」で認知症リスクが低下、明治らが1万人超の追跡調査で解明
関連記事
 血液中の微量がん細胞を検出するマイクロフィルターデバイスを開発
血液中の微量がん細胞を検出するマイクロフィルターデバイスを開発
熊本大学とオジックテクノロジーズは、1mlの血液中に含まれる微量のがん細胞を簡便に検出できる、手のひらサイズのマイクロフィルターデバイスを開発した。検出能が非常に高く、約50億個の血球細胞を含む血液中から5個のがん細胞を捕捉する。 がん細胞が酸性環境下でも生存できるメカニズムを解明
がん細胞が酸性環境下でも生存できるメカニズムを解明
大阪大学は、がん組織内の酸性環境にがん細胞が自ら最適化する現象「acid addiction」を発見した。がん細胞は、リソソームを利用した仕組みにより、酸性環境下でも細胞内のプロトンを一定レベルに保って増殖できることが分かった。 体外からがん組織を深部まで観察できる粒子を開発
体外からがん組織を深部まで観察できる粒子を開発
山口大学、徳島大学、九州大学は共同で、蛍光生体イメージングにより、体外からがん組織を深部まで観察できる近赤外蛍光、有機シリカナノ粒子を開発した。 イメージングで、組織を切らずにその場でがん診断ができる技術を開発
イメージングで、組織を切らずにその場でがん診断ができる技術を開発
大阪大学は、生体イメージング技術を応用して、組織を切り取ったり染色したりしなくても、リアルタイムに3次元で可視化できる観察技術を共同開発した。患者への負担が少ない、迅速で定量的ながんの組織診断が可能になる。 リポソームでがん細胞だけに治療遺伝子を届ける、信州大学と東芝が新手法
リポソームでがん細胞だけに治療遺伝子を届ける、信州大学と東芝が新手法
信州大学と東芝は、がん細胞に選択的に遺伝子を伝達する「がん指向性リポソーム」を開発したと発表。東芝が独自に設計した100nmサイズのナノカプセルに、信州大学 教授の中沢洋三氏らが研究を進めるがん抑制遺伝子を内包して、治療対象となるT細胞腫瘍に選択的に同遺伝子を導入することに成功。マウスによる動物実験により効果を確認した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
- ウシ由来の組織再生型靱帯で膝を切らずに再建、2028年実装目指す
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
コーナーリンク
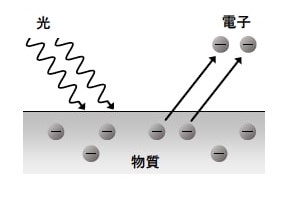 光電効果 出典:京都大学アイセムス
光電効果 出典:京都大学アイセムス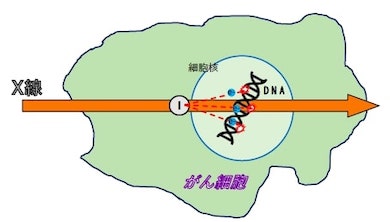 光電効果をがん細胞の中で引き起こす試み 出典:京都大学アイセムス
光電効果をがん細胞の中で引き起こす試み 出典:京都大学アイセムス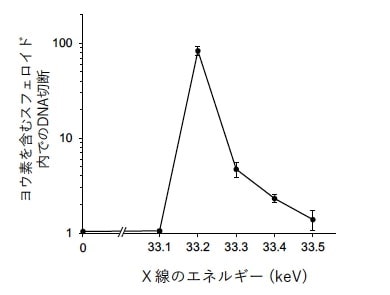 最適効果を引き起こすX線エネルギー 出典:京都大学アイセムス
最適効果を引き起こすX線エネルギー 出典:京都大学アイセムス


