遺伝情報、脂質膜、エネルギー供給を備えた人工細胞を開発:医療技術ニュース
九州大学は、脂質膜の境界を持ち、エネルギーのやり取りをしながら自律的に遺伝子発現するバイオリアクター「オンチップ膜融合型人工細胞」をミネソタ大学と共同で開発した。
九州大学は2019年7月18日、脂質膜の境界を持ち、エネルギーのやり取りをしながら自律的に遺伝子発現するバイオリアクター「オンチップ膜融合型人工細胞 On-chip membrane-bound artificial cell」を開発したと発表した。同大学大学院理学研究院 准教授の前多裕介氏らの研究グループが、ミネソタ大学と共同で開発した。
研究では、直径25μmサイズのマイクロウェルを平面脂質膜でシールし、無細胞転写翻訳の遺伝子発現を行うマイクロ流体デバイスを構築。5000個の独立した人工細胞が集積したデバイスだ。ここにplasmid DNA、もしくはゲノムDNAを含む抽出液を第1水相として封入し、脂質を含む液層を流した後にエネルギー源となる化合物を含む第2水相を流すことで、脂質膜に囲まれる人工細胞を多数デバイス上に構築した。
タンパク質量の時間経過を計測したところ、24時間以上にわたり安定して遺伝子発現し、平均濃度1mg/mlという高いタンパク質合成能力を示した。高濃度のタンパク質合成の遺伝子発現能力には、エネルギー供給のバランスを担う脂質膜の界面が不可欠であることが明らかになった。
さらに、それぞれの人工細胞が合成したタンパク質量を全て計測したところ、無細胞抽出液の量は全ての人工細胞でほぼ一定であるにもかかわらず合成タンパク質量には大きなばらつきがあった。このことから、均一な転写翻訳の反応系でも遺伝子発現量に大きなゆらぎがあることが明らかとなった。
近年、現実の細胞を模倣しながら、できる限り単純な反応系で動作するバイオリアクターの合成生物学の研究が進んでいる。しかし、従来のバイオリアクターはサイズや形状を厳密に制御できない、大規模な解析や測定が困難、脂質膜を介した物質輸送が起こらずエネルギー供給が断たれるという問題があった。
今回構築したオンチップ膜融合型人工細胞は、人工複製する細胞の設計原理の理解に役立つとしている。さらに、転写翻訳系や膜機能を阻害する抗生物質の探索などへの応用が期待できるという。
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
関連記事
 新たな機能性人工皮膚が医療機器として製造承認
新たな機能性人工皮膚が医療機器として製造承認
京都大学は、開発・改良を重ねてきた機能性人工皮膚が、医療機器として製造承認されたと発表した。細胞を加えた人工皮膚と同等の治療効果を有し、皮膚再生治療が必要な患者に対して適切なタイミングで用いることができる。 次世代型補助人工心臓の開発へ、医療機器ベンチャー企業を買収
次世代型補助人工心臓の開発へ、医療機器ベンチャー企業を買収
帝人が、補助人工心臓を開発するメドテックハートを買収すると発表。株式譲渡契約により、帝人はメドテックハートが開発を進める体外型補助人工心臓「MT-Mag」の日本および海外での承認取得、販売に向けて、本格的な取り組みを開始する。 エレクトロニクスフリーの人工膵臓、血糖値に合わせて自律的にインスリン放出
エレクトロニクスフリーの人工膵臓、血糖値に合わせて自律的にインスリン放出
名古屋大学が、機械や電気による駆動を必要としない、自立型の「人工膵臓」を開発した。この人工膵臓は、健常および糖尿病マウスにおいて3週間以上持続して、糖代謝を良好に制御した。従来の機械型膵臓に比べ、安価で使用負担も軽減する。 植込み型補助人工心臓システムの製造販売承認を取得
植込み型補助人工心臓システムの製造販売承認を取得
日本メドトロニックは、重症心不全の治療に用いられる「植込み型補助人工心臓システム HVAD」の製造販売承認を取得した。ポンプ内部のインペラと軸部は非接触で、血球成分へのダメージを低減することが期待されている。 マイクロニードル型「貼るだけ」人工膵臓のプロトタイプを開発
マイクロニードル型「貼るだけ」人工膵臓のプロトタイプを開発
名古屋大学は、エレクトロニクス制御フリー、タンパク質フリー、ナノ粒子フリーのマイクロニードル型「貼るだけ」人工膵臓のプロトタイプを開発した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 医療および製薬DX市場は2035年に1.3兆円規模へ、AI創薬が急成長のけん引役に
コーナーリンク
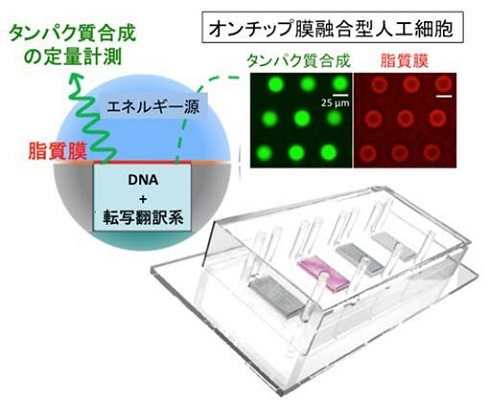 オンチップ膜融合型人工細胞の概要 出典:九州大学
オンチップ膜融合型人工細胞の概要 出典:九州大学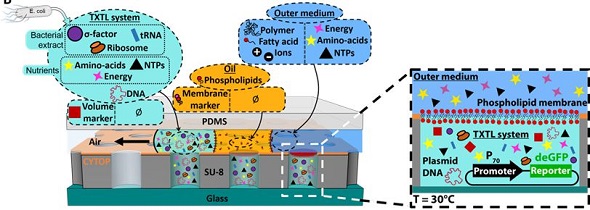
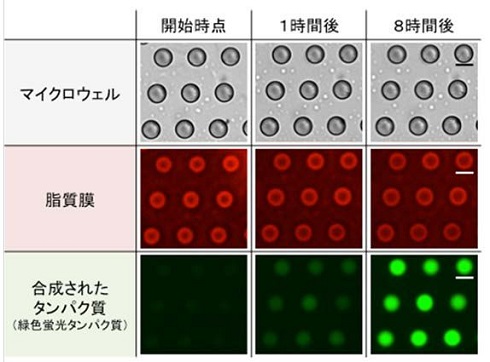 オンチップ膜融合型人工細胞における脂質膜(赤色)と遺伝子発現(緑色) 出典:九州大学
オンチップ膜融合型人工細胞における脂質膜(赤色)と遺伝子発現(緑色) 出典:九州大学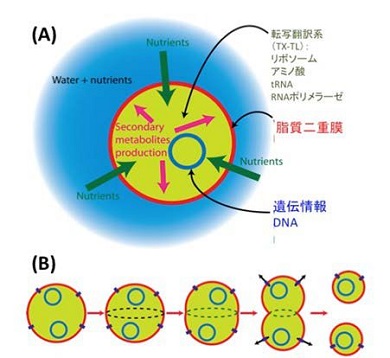 人工細胞(A)と自己複製(B)の概念図 出典:九州大学
人工細胞(A)と自己複製(B)の概念図 出典:九州大学