100年来の謎、大腸がんの代謝が変化する仕組みを解明:医療技術ニュース
慶應義塾大学は、100年来の謎だった、がんの代謝を制御する因子を初めて明らかにした。大腸がんの代謝に関わるのはがん遺伝子MYCであり、MYCとMYCが制御する代謝酵素遺伝子の発現を抑制することで、大腸がん細胞の増殖も抑制された。
慶應義塾大学は2017年8月29日、100年来の謎だった、がんの代謝を制御する因子を初めて明らかにしたと発表した。同大学 先端生命科学研究所 教授の曽我朋義氏、香川大学医学部 教授の鈴木康之氏、国立がん研究センター ユニット長の谷内田真一氏、愛知県がんセンター研究所 部長の青木正博氏らの研究グループによるもので、成果は同日、「米国科学アカデミー紀要(Proceeding of National Academy of Sciences of the United States of America)」の電子版に掲載された。
同研究グループは、大腸がん患者275人からがん組織と正常組織を採取し、それぞれの組織に存在する数百の代謝物を測定した。その結果、ほとんどの代謝物の濃度が良性腫瘍の段階に変化し、ステージが進行しても変化しないことが分かった。また、代謝に関与する遺伝子やApc変異マウスの組織解析でも、大腸がんの代謝や変化は良性腫瘍で起こり、がんのステージには関係しないことが確認できた。
次に、大腸がんの発症に関わるがん遺伝子、がん抑制遺伝子APC、KRAS、TP53について、これらの変異が代謝物の濃度に影響を与えるかを検証したところ、代謝物の濃度の変動には影響を与えないことが判明した。
そこで、何が大腸がん組織の代謝を制御しているかを調べるため、臨床検体とApc変異マウスの遺伝子発現の結果を精査した。その結果、がん遺伝子MYCが臨床検体の大腸がん組織で7倍、Apc変異マウスの良性腫瘍で3倍と、正常組織に比べて高発現していた。さらに、MYC遺伝子が、160種類の代謝関連酵素遺伝子の発現を介して215の代謝反応を制御していることが分かった。MYC遺伝子の発現を抑制すると、160種類の代謝関連酵素遺伝子の発現変動がリセットされ、大腸がん細胞の増殖も著しく抑制された。MYCが制御する代謝酵素の遺伝子発現を抑制することでも、大腸がん細胞の増殖は抑制された。
これらのことから、大腸がんの代謝を制御するのはMYCであり、MYCが良性腫瘍の段階で発現することで代謝が劇的に変動していることを臨床検体で初めて証明した。この代謝の変動(栄養源の供給)が、細胞のがん化と増殖に不可欠と考えられる。同成果から、MYCとMYCが制御するピリミジン代謝酵素遺伝子(CADなど)が、大腸がんの治療標的として有望であることが示された。今後、大腸がんの予防法や治療法の開発につながることが期待される。
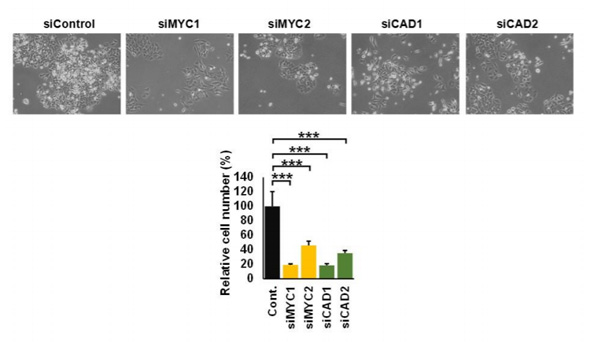 MYCおよびMYCパスウェイの遺伝子抑制による大腸がん細胞の増殖試験。大腸がん細胞(左)に対して、MYC遺伝子を抑制(左から2番目と3番目)、あるいはMYCの標的であるピリミジン代謝経路のCAD遺伝子(左から4番目と5番目)を抑制すると、大腸がん細胞の増殖が抑制された(クリックして拡大) 出典:慶應義塾大学
MYCおよびMYCパスウェイの遺伝子抑制による大腸がん細胞の増殖試験。大腸がん細胞(左)に対して、MYC遺伝子を抑制(左から2番目と3番目)、あるいはMYCの標的であるピリミジン代謝経路のCAD遺伝子(左から4番目と5番目)を抑制すると、大腸がん細胞の増殖が抑制された(クリックして拡大) 出典:慶應義塾大学関連記事
 大腸がん幹細胞を標的とした治療モデルの開発に成功
大腸がん幹細胞を標的とした治療モデルの開発に成功
慶應義塾大学は、大腸がんの増殖をつかさどる「がん幹細胞」の詳細な機能の解析と、がん幹細胞を標的とした治療モデルの開発に成功した。がんの新たな根源的治療法の開発につながることが期待される。 大腸がんなどの病変をAIで98%検知するリアルタイム内視鏡診断サポートシステム
大腸がんなどの病変をAIで98%検知するリアルタイム内視鏡診断サポートシステム
国立がん研究センターとNECは、AIを用いて大腸がんや前がん病変を内視鏡検査時にリアルタイムに発見するシステムを開発した。大腸がんなどの病変を98%の発見率で自動検知し、病変見逃しの改善が期待される。 組織を切らず、リアルタイムに大腸がんを診断できる技術
組織を切らず、リアルタイムに大腸がんを診断できる技術
大阪大学は、固定/染色などの工程なしに、生きた組織のまま大腸の深部まで観察し、大腸がんをリアルタイムに診断できる方法を開発した。従来の方法よりも低侵襲かつ定量的に、正常の大腸組織や大腸がんの組織を診断することが可能になる。 乳がんや大腸がんを1回の採血で発見する診断システム、NEDOが開発に着手
乳がんや大腸がんを1回の採血で発見する診断システム、NEDOが開発に着手
新エネルギー・産業技術総合開発機構(NEDO)は、乳がんや大腸がんなどを1回の採血で発見する診断システムの開発プロジェクトに着手する。がんの種類を判別するためのマーカーとして着目しているのが、マイクロRNAと呼ばれる物質だ。 尿中代謝物で、健常者、乳がん患者および大腸がん患者の尿検体を識別
尿中代謝物で、健常者、乳がん患者および大腸がん患者の尿検体を識別
日立製作所は、住友商事グループと共同で、尿中の代謝物を網羅的に解析することにより、健常者、乳がん患者および大腸がん患者の尿検体を識別する基礎技術の開発に成功した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
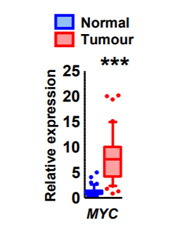 大腸の正常組織とがん組織のMYCの発現。大腸の正常組織に対して、がん組織ではMYC遺伝子が平均で7倍高く発現していた 出典:慶應義塾大学
大腸の正常組織とがん組織のMYCの発現。大腸の正常組織に対して、がん組織ではMYC遺伝子が平均で7倍高く発現していた 出典:慶應義塾大学


