分解速度が遅い人工インスリンの合成に成功、糖尿病治療薬への応用見込む:医療技術ニュース
東海大学は、新規人工インスリン「セレノインスリン」の化学合成に成功した。インスリン分解酵素による分解速度が天然インスリンより遅く、糖尿病の治療薬としての応用が期待される。
東海大学は2017年4月12日、新規人工インスリン「セレノインスリン」の化学合成に成功したと発表した。インスリン分解酵素(IDE)による分解速度が天然インスリンより著しく遅く、糖尿病の治療薬としての応用が期待される。
インスリンは、2本の異なるポリペプチド鎖(A鎖/B鎖)が、硫黄原子(S)同士の「ジスフィルド(SS)結合」によって安定化されている。A鎖とB鎖を人工的に結び付ける従来の研究では、それぞれに含まれる硫黄同士が結合してしまい、インスリンはうまく合成できなかった。
同研究では、A/B両鎖の硫黄原子の1つをより反応性の高いセレン原子(Se)に置き換えることで、両鎖を「ジセレニド(SeSe)結合」で架橋したセレノインスリンを合成することに「世界で初めて」(東海大学)、成功した。まず、Se含有インスリンA鎖およびB鎖の化学合成を行い、各ペプチド鎖を最適な条件下で混合・反応させることで、目的のセレノインスリンを最大27%の単離収率で得た。
次に、X線結晶構造解析によって3次元立体構造を解析したところ、セレノインスリンは天然のインスリンとほぼ同じ立体構造を持っていることが分かった。さらに、セレノインスリンによる細胞刺激応答を観察し、その生理活性を評価した結果、セレノインスリンは“インスリン”としての生理機能を保持していることが判明した。
また、インスリンを投与すると血流によって体内を循環し、最終的に腎臓内でIDEによって分解され、尿として排出される。そこでIDEを用いて、天然インスリンとセレノインスリンの分解実験を行ったところ、セレノインスリンは天然インスリンよりも分解速度が著しく遅いことが分かった。
これらの結果から、セレノインスリンは体内での薬効が長時間持続すると考えられる。そのため、長時間にわたって体内で循環・作用し、インスリンの基礎分泌を補助する新しい持効型インスリン製剤への応用が期待でき、将来的には患者の投薬負担が減らせるという。
同研究は、同大学理学部の荒井堅太講師と岩岡道夫教授、東北大学多元物質科学研究所の稲葉謙次教授、大阪大学蛋白質研究所の北條裕信教授らの研究グループによって行われた。成果は同月10日付でドイツの国際化学誌「Angewandte Chemie International Edition」電子版に掲載された。
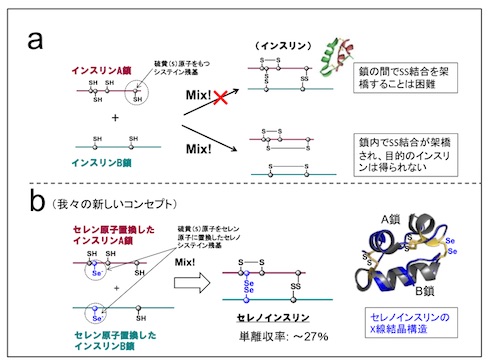 (a)天然のインスリンA鎖およびB鎖を用いたインスリン合成の概略。(b)セレン原子置換したインスリンA鎖およびB鎖を用いたセレノインスリンの合成の概略とセレノインスリンのX線結晶構造(クリックして拡大) 出典:東海大学
(a)天然のインスリンA鎖およびB鎖を用いたインスリン合成の概略。(b)セレン原子置換したインスリンA鎖およびB鎖を用いたセレノインスリンの合成の概略とセレノインスリンのX線結晶構造(クリックして拡大) 出典:東海大学- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
- 血液検査で認知症の予兆をキャッチする技術を開発
- 「週1回のチーズ」で認知症リスクが低下、明治らが1万人超の追跡調査で解明
- 浴室ぬめりや生乾き臭を1時間で撃退、負イオンがオゾンの酸化作用に作用
- 連邦政府封鎖明けからAI駆動型デジタルヘルス活用が急加速する米国の医療DX
- ゼブラフィッシュ胚でノロウイルスの人工合成に成功
関連記事
 血糖を調節する新たなメカニズムを解明
血糖を調節する新たなメカニズムを解明
京都大学は、ナルディライジンというタンパク質が、血糖上昇時のインスリン分泌に不可欠であり、血糖値を一定の範囲に維持するために重要な働きを担っていることを明らかにした。 ヒトのウイルス糖尿病リスク遺伝子を発見
ヒトのウイルス糖尿病リスク遺伝子を発見
九州大学大学院医学研究院の永淵正法教授は、ヒトのウイルス糖尿病リスク遺伝子を同定した。ヒトTYK2遺伝子多型が、広く糖尿病の発症リスクとなり、特にウイルス感染後に1型糖尿病にかかるリスクが高いことが分かった。 少量の血液で測定できる、糖尿病患者向け血糖自己測定器を発売
少量の血液で測定できる、糖尿病患者向け血糖自己測定器を発売
ジョンソン・エンド・ジョンソン メディカルカンパニーは、糖尿病患者向けの血糖自己測定器「ワンタッチベリオIQ」を発売した。0.4μL以上という少量の血液で、血糖値が測定できる。 HLAタンパク質の安定性が1型糖尿病などの自己免疫疾患に関係
HLAタンパク質の安定性が1型糖尿病などの自己免疫疾患に関係
東京大学大学院医学系研究科の研究グループは、1型糖尿病のかかりやすさに関連するヒト白血球抗原(HLA)遺伝子型が、安定性が顕著に低いHLAタンパク質を作ることを見出した。 糖尿病を10分で検査できるキット、田中貴金属工業が中国やインドに提供へ
糖尿病を10分で検査できるキット、田中貴金属工業が中国やインドに提供へ
田中貴金属工業は、約10分で糖尿病を簡易検査できるスクリーニングキット「PersonalA1c(パーソナルエーワンシー)」を開発した。中国や台湾、インドで2015年の販売開始を目指す。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク
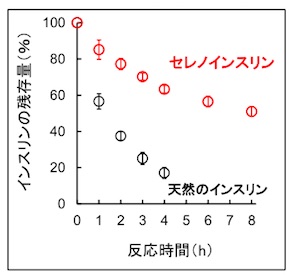 IDEによるセレノインスリンと天然のインスリンの分解反応速度の比較 出典:東海大学
IDEによるセレノインスリンと天然のインスリンの分解反応速度の比較 出典:東海大学


