アミロイドβの悪玉化機構を解明、アルツハイマー病の新規創薬へ:医療技術ニュース
理化学研究所らは、アルツハイマー病患者の脳内において、アミロイドβが、分解されにくい悪玉アミロイドβへと変化する仕組みを解明した。アルツハイマー病の予防や治療に関する新しい薬剤の開発が期待される。
理化学研究所は2024年10月11日、アルツハイマー病(AD)患者の脳内でアミロイドベータ(Aβ)が、分解されにくい悪玉Aβに変化する仕組みを解明したと発表した。長崎大学らとの国際共同研究による成果だ。
ADは、脳内に大量に蓄積したAβによって脳の神経細胞が正常に機能しなくなり、認知機能や記憶能力が障害を受ける疾患だ。Aβは正常な脳でも作られ(生理的Aβ)、通常はネプリライシンによって分解除去されるが、AD患者の脳ではネプリライシンを作り出す力が極端に弱くなるため、Aβが壊れず正常の老化状態を超えて蓄積されてしまう。
AD患者の脳に蓄積してアミロイド斑を作るAβのほとんどは悪玉Aβで、ピログルAβと呼ばれる。ピログルAβについては、早期AD治療薬の抗体医薬として日本でも認可されたドナネマブの標的Aβとして知られるようになるなど、研究が進んでいるが、Aβから悪玉Aβに変化する仕組みや、脳内で蓄積していく過程は明らかになっていなかった。
今回の研究では、ネプリライシンを働かないようにしたADのモデルマウスを使用した。同マウスを調べると、ネプリライシンの代わりに別の酵素エキソペプチダーゼが増えて、Aβを分解するようになった。しかし、分解の過程でグルタミン酸環化酵素がAβに飾りを付け(ピログルタミル化)、その飾りが分解を阻止するため、悪玉Aβとなって蓄積していくことが分かった。
また、ADの画像診断で用いられるピッツバーグ化合物B(PiB)で、ADモデルマウスのアミロイドイメージングを試みたところ、PiBシグナルは、ピログルAβ量の増加と一致し、マウスの月齢経過とともに増加していた。これにより、PiBプローブでピログルAβの増加や脳内のネプリライシン量の変化を把握できることが確認された。
続いて、ネプリライシンの代わりにAβの分解を補償するエキソペプチダーゼの働きから、アミノペプチダーゼ、ジペプチジルペプチダーゼ、グルタミン酸環化酵素に注目し、Aβと反応させた。
その結果、ネプリライシンを働かないようにしたADモデルマウスにおいて、アミノペプチダーゼとジペプチジルペプチダーゼの発現量が、マウスの月齢依存的に増加した。グルタミン酸環化酵素については、1つの類似タンパク質の発現量が増加する一方で、ピログルタミル化したグルタミン酸残基をペプチドから外すアミノペプチダーゼの発現量が低下していた。
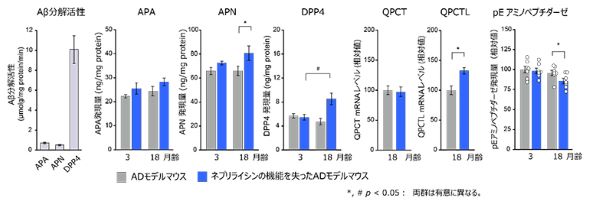 ネプリライシンの機能低下による二次的なAβ分解経路構成酵素群の誘導。APA:アミノペプチダーゼA、APN:アミノペプチダーゼN、DPP4:ジペプチジルペプチダーゼ4、QPCT:グルタミン酸環化酵素、QPCTL:グルタミン酸環化酵素様タンパク質[クリックで拡大] 出所:理化学研究所
ネプリライシンの機能低下による二次的なAβ分解経路構成酵素群の誘導。APA:アミノペプチダーゼA、APN:アミノペプチダーゼN、DPP4:ジペプチジルペプチダーゼ4、QPCT:グルタミン酸環化酵素、QPCTL:グルタミン酸環化酵素様タンパク質[クリックで拡大] 出所:理化学研究所ドナネマブは、既に脳に蓄積しているピログルAβを標的とするが、Aβの分解経路を構成する酵素群が確認されたことで、ピログルAβ化を事前に防げる可能性がある。また、ピログルAβ化に関わる酵素の働きを抑える薬が開発されることで、新しいアルツハイマー病の予防や治療につながることが期待される。
関連記事
 受動喫煙が片頭痛の誘発因子であることを示唆
受動喫煙が片頭痛の誘発因子であることを示唆
慶應義塾大学は、タバコの煙に暴露した雌マウスは暴露していない雌マウスに比べて片頭痛の感受性が有意に高まることを明らかにした。受動喫煙が片頭痛の誘発因子の一つである可能性を示唆する結果だ。 アルツハイマー病やALSの原因物質などを超高感度に検出する技術を開発
アルツハイマー病やALSの原因物質などを超高感度に検出する技術を開発
岐阜大学は、新たに発見した界面活性剤「Brij-58」を活用し、神経変性疾患の発症に関わるTDP-43およびアミロイドβ凝集体の超高感度検出技術を開発した。脳組織に蓄積した病的凝集体の検出が可能だ。 点滴ラインの絡まりを防ぎ簡単に長さを調節できるデバイスを開発
点滴ラインの絡まりを防ぎ簡単に長さを調節できるデバイスを開発
東北大学らは、点滴ラインの絡まりを防ぎ、長さ調整を容易にするデバイス「カラフルラインホルダー」を開発した。YKアクロスが全国販売を開始する予定だ。 遠隔手術支援および手術映像の教育活用の実証実験に成功
遠隔手術支援および手術映像の教育活用の実証実験に成功
丸紅らは、手術記録システム「OPeDrive」と高セキュリティな接続を提供する「MECダイレクト」を活用した遠隔手術支援の実証実験に成功した。医療従事者向け教育プラットフォームの提供を開始する。 画像由来や音楽由来の感情に関連する脳部位を特定
画像由来や音楽由来の感情に関連する脳部位を特定
情報通信研究機構(NICT)らは、fMRIを用いた心理実験により、映像視聴時に視覚や聴覚から感情が喚起されたときに異なる活動をする脳部位を特定した。 水道水より浄水で顆粒だしを調製した方が、不快臭が少ないことを発見
水道水より浄水で顆粒だしを調製した方が、不快臭が少ないことを発見
LIXILは、顆粒だしを水道水で調製すると、残留塩素により不快臭の原因物質であるアルデヒド類が生成されることを発見した。残留塩素を除去した浄水で調製すると、アルデヒド類由来の不快臭は抑えられた。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク
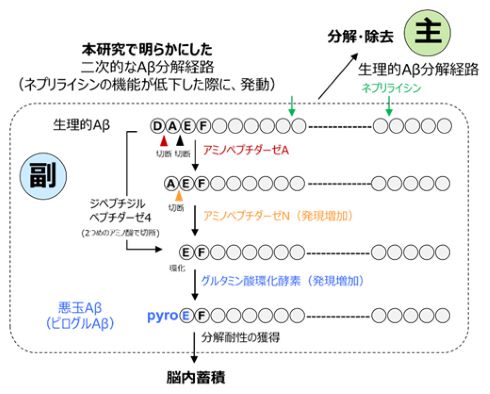 悪玉Aβが作られる仕組み 出所:理化学研究所
悪玉Aβが作られる仕組み 出所:理化学研究所


