細胞外の脂質代謝がアレルギーの感受性に関与する:医療技術ニュース
東京大学らは、マスト細胞と線維芽細胞の相互作用により放出される細胞外小胞の膜上で起こる脂質代謝が、マスト細胞の成熟を制御し、アレルギーの感受性を決めることを発見した。
東京大学は2024年7月16日、マスト細胞と線維芽細胞の相互作用により放出される細胞外小胞の膜上で起こる脂質代謝が、線維芽細胞との細胞間コミュニケーションを介してマスト細胞の成熟を制御し、アレルギーの感受性を決めることを発見したと発表した。東京理科大学らとの共同研究による成果だ。
30種類以上の脂質代謝関連分子の欠損マウスを網羅的に表現型解析した結果、研究チームがこれまでに報告した、III型分泌性ホスホリパーゼA2(PLA2G3)、プロスタグランジンD2(PGD2)の合成酵素L-PGDSとその受容体DP1に加えて、リゾリン脂質の1種リゾホスファチジン酸(LPA)の受容体LPA1が欠損すると、マスト細胞の顆粒に含まれるアレルギー物質の量が減少し、アレルゲンに対する応答性が低下することを明らかにした。
また、LPA1受容体の制御下にある成熟関連分子の探索により、マスト細胞の成熟には、LPA1受容体の下流でインテグリンとそのリガンドによる細胞間の接着強化が必要であることが分かった。
マスト細胞と共培養した線維芽細胞では、LPA合成酵素のオートタキシン(ATX)とLPA1受容体、マスト細胞の成熟を促すインターロイキン33(IL-33)の発現が誘導された。他にも、L-PGDS発現はLPA1受容体を通じて上昇し、PGD2の産生が高まること、皮膚組織でこれらの鍵分子がマスト細胞と隣接する特定の線維芽細胞に発現していることを確認した。
さらに、脂質を網羅的に分析した結果から、PLA2G3欠損マウスの皮膚や細胞外小胞で、PLA2G3の代謝産物であるリゾリン脂質が野生型と比べて減少していることが明らかとなった。
PLA2G3を欠損したマスト細胞は、線維芽細胞と共培養しても成熟しなかったが、LPA1受容体作動薬や野生型細胞小胞を補充することで成熟が回復した。なお、この脂質経路は、ヒトのマスト細胞と線維芽細胞の共培養系でも確認され、LPA1受容体阻害薬によってヒトマスト細胞の成熟は阻害された。
今回の研究結果から、LPAが、線維芽細胞との細胞間コミュニケーションによりマスト細胞の成熟を制御する中心因子であることが明らかとなった。この脂質代謝経路はどのステップを阻害してもマスト細胞の成熟とアレルギー応答性が妨げられるため、同経路をターゲットとした創薬が、アレルギー疾患の予防治療法の開発につながる可能性がある。
関連記事
 整形外科腫瘍学への3Dプリントモデルの使用の評価を目的に臨床試験を実施
整形外科腫瘍学への3Dプリントモデルの使用の評価を目的に臨床試験を実施
StratasysとRicoh USAは、整形外科腫瘍学への3Dプリントモデルの使用の評価を目的とした臨床試験で最初の患者を登録した。患者個別の3Dプリント人体モデルの有効性を評価する。 温度感受性TRPV4チャネルが発汗に関与することが明らかに
温度感受性TRPV4チャネルが発汗に関与することが明らかに
自然科学研究機構 生理学研究所は、マウスの発汗において、温度感受性TRPV4イオンチャネルとアノクタミン1の機能関連が関与することを明らかにした。また、ヒトの汗腺でも、TRPV4イオンチャネルの発現が低下していることも分かった。 新型コロナウイルスの糖鎖と結合し、感染を抑制する天然物を特定
新型コロナウイルスの糖鎖と結合し、感染を抑制する天然物を特定
名古屋大学らは、放線菌が生産する天然物のプラディミシンAが、新型コロナウイルス表面の糖鎖と結合し、感染を抑制することを発見した。糖鎖構造はウイルス変異で変化しにくいため、さまざまな変異株に有効な抗SARS-CoV-2薬の開発が期待される。 Stratasys、リアルな人体モデルを造形できる医療分野向け新型3Dプリンタを発売
Stratasys、リアルな人体モデルを造形できる医療分野向け新型3Dプリンタを発売
Stratasysは、新しい3Dプリンタ「J5 Digital Anatomy」を発表した。患者個別のリアルな人体モデルを作成できるため、患者の予後改善や医療業務の効率化、医療機器の迅速な開発に役立つ。 オリンパスの新CFOは伊藤忠出身、“数字”の管理で成長を支える
オリンパスの新CFOは伊藤忠出身、“数字”の管理で成長を支える
オリンパスが新CFOである泉竜也氏の合同取材に応じた。泉氏は「当社がグローバル・メドテックカンパニーを目指していくためには、経営に関わるさまざまな“数字”を管理するCFOが果たすべき役割は大きい。この“数字”をよりタイムリーに分析できる体制整備を進めていく」と語る。 次世代の「水道哲学」に挑戦、パナソニックHDが技術未来ビジョンを発表
次世代の「水道哲学」に挑戦、パナソニックHDが技術未来ビジョンを発表
パナソニック ホールディングスは、約10年ぶりに長期の技術開発の方向性を定めた「技術未来ビジョン」を発表した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
コーナーリンク
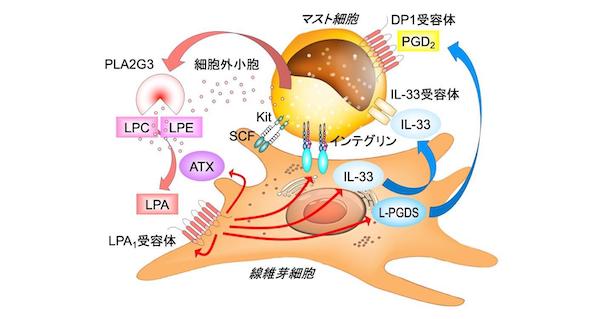
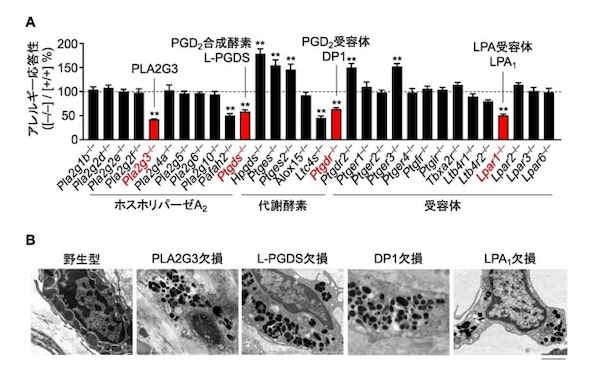 アレルギーに関わる脂質代謝関連分子の網羅的探索 出所:東京大学
アレルギーに関わる脂質代謝関連分子の網羅的探索 出所:東京大学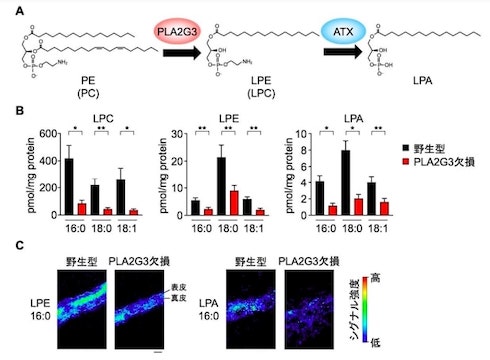 PLA2G3の欠損によってリゾリン脂質の産生が低下する 出所:東京大学
PLA2G3の欠損によってリゾリン脂質の産生が低下する 出所:東京大学