AI医療機器やGCP査察を巡る多国間連携と働き方改革、日本のPMDAの対応は:海外医療技術トレンド(109)(4/4 ページ)
プロセス/文書のデジタル化を生かした遠隔規制評価
さらに、前述の合同ワークショプでは、遠隔規制評価(RRA)が議論されている。FDAのプレゼンテーションでは、傘下の研究インテグリティ・サーベイランス室(OSIS)によるIn Vivoの生物学的利用率/生物学的同等性(BA/BE)研究の監視をケーススタディーとして報告している(関連情報)。
FDAは、遠隔規制評価について、適用されるFDAの要求事項の順守状況を評価するために、全体を通して遠隔で実施されるFDAの規制対象事業所および/または記録に関する検査と定義している。遠隔規制評価は、人や動物の健康の保護、規制上の決定事項の周知、当局に提出した特定の情報の検証を支援するものだとしている。
図4は、FDAの説明資料より、遠隔規制評価と査察の比較を示したものである。
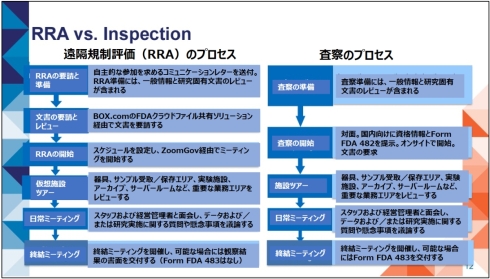 図4 遠隔規制評価(RRA)と査察の比較[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Session 1 (BE): Remote Evaluations」(2024年2月15日)を基にヘルスケアクラウド研究会作成
図4 遠隔規制評価(RRA)と査察の比較[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Session 1 (BE): Remote Evaluations」(2024年2月15日)を基にヘルスケアクラウド研究会作成FDAは、COVID-19パンデミック緊急事態下で査察活動が大幅に制限された教訓から、全てを遠隔で完結できる遠隔規制評価を有効活用して、対面業務を前提としてきた査察の物理的・経済的負荷を低減するとともに、データインテグリティなど品質保証の課題解決に取り組んでいる。
参考までにFDAは、2024年1月26日、「遠隔規制評価の実施 - 質問と回答 - 業界向けガイダンス草案」を公表している(関連情報)。本ガイドライン草案では、遠隔規制評価について、義務的な評価と自主的な評価の2種類を設定している。遠隔規制評価の対象となるのは、連邦食品・医薬品・化粧品(FD&C)法が適用される各製品であり、医療機器も含まれる。
今回公表した草案の構成は以下のようになっている。
- I.イントロダクション
- II.背景
- III.質問と回答
- A.遠隔規制評価の基礎
- 1.RRAは何か?
- 2.誰がRRAの対象になる可能性があるか?
- 3.RRAは、査察外の情報を取得するその他の確立した手段を置き換えているか?
- 4.RRAは査察か?
- 5.FDAは、いつ、RRAの実施を開始または要求する可能性があるか?
- 6.FDAは、事業所に対するFDA査察の期間中または一部として、RRAを利用するか?
- 7.RRAの便益は何か?
- B.遠隔規制評価の見通し
- 8.FDAは、どのような方法で、RRAを要求する可能性があるか?
- 9.事業所は、RRAの期間中、どのようなことが起きると想定できるか?
- 10.RRAの参画を断ると、いかなる結果があるか?
- 11.RRAに対する技術的見通しは何かあるか?
- C.遠隔規制評価の一部としての記録またはその他の情報の要求
- 12.FDAは、RRAの一部として、どのような記録またはその他の情報を要求する可能性があるか?
- 13.FDAは、どのような目的で、RRAの期間中に収集した記録およびその他の情報を利用する可能性があるか?
- 14.RRAが、記録またはその他の方法を要求する場合、記録およびその他の情報をFDAに提出するために、どのようなタイムフレームがあるか?
- 15.RRAの要求に対応して、どのような方法で、記録またはその他の情報を、FDAに提供すべきか?
- 16.RRAの完了に際して、どんなことが起きる可能性があるか?
- A.遠隔規制評価の基礎
国境を越えたGCP査察関連業務の働き方改革への日本の対応は?
FDAが公表した「2022年次事業所査察報告書」(関連情報)によると、2022年(暦年)時点で、FDA査察の対象となる登録医薬品事業所数が1万5088(内米国内:1万74、米国外:5014)、登録医療機器事業所数が4万3713(内米国内:2万289、米国外:2万3424)となっていた。これは、医薬品の場合33.2%、医療機器の場合53.5%の査察対象事業所が米国外にあることを意味する。
FDAの国境を越えた働き方改革に関しては、米国会計検査院(GAO)が、2022年1月14日に「FDA労働力:医療製品スタッフによる現在および将来のニーズの充足を保証するために政府機関全体の労働力計画策定が必要である」(関連情報)を公表し、2024年2月22日に「臨床研究:FDAは査察労働力の採用・維持への取組を評価すべきである」(関連情報)と題する報告書を公表するなど、連邦政府全体の大きな課題となっている。FDAにとっては、時間や費用を要する海外適用事業所に対する規制監督業務を、デジタル技術の導入や海外当局との連携により、効率化/自動化していくことが急務となっている。前述のシンポジウムにおいても、FDAは、積極的な姿勢を示している(関連情報)。
このような米国内の動きと並行して、英国MHRAは、2024年5月21日に声明を発表し(関連情報)、米国FDA、カナダ保健省の他、オーストラリア薬品・医薬品行政局(TGA)、欧州連合(EU)と連携して、医療機器の相互承認に向けたフレームワークを開発する方針を打ち出した。新たなMHRAの政策は、品質が保証された医療機器への安全なアクセスを保証し、複数当局による評価の重複を低減することによって、利用可能なリソースを、患者の健康にベネフィットがある製品のイノベーションに仕向けることを目的としている。具体的なフレームワークの詳細については、現在、草案を策定中だとしている。
そしてMHRAは、声明の中で、日本の医薬品医療機器総合機構(PMDA)との間で、同様の医療機器の相互承認に関する議論を行っていることも公表している。PMDAは、コロナ禍の緊急対策としてリモート調査を導入した(関連情報)。今後、このような経験や知見を、どのような形でAI時代の規制監督業務に反映させるのかに対しては、海外規制当局も注目している。前述の米国会計検査院報告書で指摘された査察人材不足は、民間企業の品質保証部門にとっても、ヘルステックイノベーションの阻害要因となりかねない課題である。
筆者プロフィール
笹原英司(ささはら えいじ)(NPO法人ヘルスケアクラウド研究会・理事)
宮崎県出身。千葉大学大学院医学薬学府博士課程修了(医薬学博士)。デジタルマーケティング全般(B2B/B2C)および健康医療/介護福祉/ライフサイエンス業界のガバナンス/リスク/コンプライアンス関連調査研究/コンサルティング実績を有し、クラウドセキュリティアライアンス、在日米国商工会議所、グロバルヘルスイニシャチブ(GHI)等でビッグデータのセキュリティに関する啓発活動を行っている。
Twitter:https://twitter.com/esasahara
LinkedIn:https://www.linkedin.com/in/esasahara
Facebook:https://www.facebook.com/esasahara
関連記事
- ≫連載「海外医療技術トレンド」バックナンバー
 カナダが目指す持続可能な生成AIイノベーションの枠組みづくり
カナダが目指す持続可能な生成AIイノベーションの枠組みづくり
本連載第46回でカナダのケベック州のAIハブ都市であるモントリオールを取り上げ、第94回ではカナダ当局の生成AI法規制動向を取り上げた。今回は、カナダにおける生成AIイノベーションを巡るデータセキュリティ、プライバシー、サステナビリティなどのガバナンス動向に焦点を当てる。 AI実装に踏み込む米国FDAの医療機器ガイドライン策定計画
AI実装に踏み込む米国FDAの医療機器ガイドライン策定計画
本連載第78回、第79回と、欧州の医療機器に関わる規制動向を取り上げた。一方、米国のFDAはAIをはじめとする新技術利用に重点を置いた規制改革を推進している。 ICT先進国エストニアのバイオバンクとクラウドネイティブ技術
ICT先進国エストニアのバイオバンクとクラウドネイティブ技術
本連載第30回および第96回で、デジタルヘルス先進国エストニア発のICTの事業展開を紹介したが、今回はバイオバンクの取り組みを取り上げる。 欧州AI法やEHDSが進化を促すプライバシー強化技術の有力ディープテック
欧州AI法やEHDSが進化を促すプライバシー強化技術の有力ディープテック
本連載第93回で、一般データ保護規則(GDPR)を起点とする欧州のプライバシー保護技術(PET)の標準化と産業創出支援活動を取り上げたが、AI法や欧州保健データスペース(EHDS)の本格施行を控えて、PETを担うディープテックの活動が加速している。 医療機器よりも難題!? Non-SaMDに影響が及ぶ米国のIoTセキュリティ政策
医療機器よりも難題!? Non-SaMDに影響が及ぶ米国のIoTセキュリティ政策
米国では、本連載第98回で取り上げた消費者IoT製品向け認証/ラベリングプログラム「U.S.サイバートラストマーク」の導入準備など、非医療機器/Non-SaMD(Software as a Medical Device)を取り巻く動きが加速している。
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク



