AI医療機器やGCP査察を巡る多国間連携と働き方改革、日本のPMDAの対応は:海外医療技術トレンド(109)(1/4 ページ)
本連載第104回で米国、カナダ、英国のAI医療機器指導原則を取り上げたが、それと並行して国境を越えた規制監督業務DXの取り組みも進んでいる。
本連載第104回で米国、カナダ、英国のAI(人工知能)医療機器指導原則を取り上げたが、それと並行して国境を越えた規制監督業務DX(デジタルトランスフォーメーション)の取り組みも進んでいる。
AI医療機器の透明性に関わる米国、カナダ、英国当局の連携強化
2024年6月13日、米国食品医薬品局(FDA)は、英国医薬品・医療製品規制庁(MHRA)およびカナダ保健省と共同で「機械学習対応医療機器向けの透明性:指導原則」を公表した(図1、関連情報)。
 図1 米国食品医薬品局(FDA)、英国医薬品・医療製品規制庁(MHRA)、カナダ保健省「機械学習対応医療機器向けの透明性:指導原則」(2024年6月13日)[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Transparency for Machine Learning-Enabled Medical Devices: Guiding Principles」(2024年6月13日)
図1 米国食品医薬品局(FDA)、英国医薬品・医療製品規制庁(MHRA)、カナダ保健省「機械学習対応医療機器向けの透明性:指導原則」(2024年6月13日)[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Transparency for Machine Learning-Enabled Medical Devices: Guiding Principles」(2024年6月13日)本連載第80回で触れたように、米国、カナダ、英国の規制当局は共同で、2021年10月27日に「医療機器開発向けグッド・マシンラーニングプラクティス(GMLP):指導原則」を公表し(関連情報)、2023年10月24日には「機械学習対応医療機器向け事前変更管理計画:指導原則」を公表していた(関連情報)。
透明性の指導原則は、GMLP指導原則の10項目のうち、特に以下の2項目に基づいて構築されている。
- 7.焦点は、人間−AIチームのパフォーマンスに置かれる
- 9.ユーザーには、明確で不可欠な情報が提供される
ここでは、「透明性」について、MLMD(意図した使用、開発、パフォーマンス、そして可能な場合はロジックなど)に関する適正な情報が、関連するオーディエンスに伝達される度合いと定義している。また、「ロジック」については、アウトプットまたは結果に到達する方法や、意思決定または行動の基盤に関する情報であり、このロジックを個人が理解できるような方法で説明できる度合いが「説明可能性」だと定義している。さらに、透明性に関連した重要なコンセプトとして、「人間中心設計」を掲げている。これは、ユーザーエクスペリエンス全体に取組む反復的なプロセスであり、設計開発を通して関連する主体が含まれる。
表1は、透明性の指導原則の概要を示しており、5W(Who、Why、What、Where、When)1H(How)の6原則から構成されている。
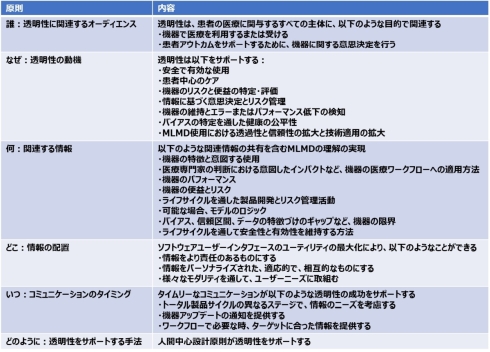 表1 機械学習対応医療機器向けの透明性:指導原則の概要[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Transparency for Machine Learning-Enabled Medical Devices: Guiding Principles」(2024年6月13日)を基にヘルスケアクラウド研究会作成
表1 機械学習対応医療機器向けの透明性:指導原則の概要[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Transparency for Machine Learning-Enabled Medical Devices: Guiding Principles」(2024年6月13日)を基にヘルスケアクラウド研究会作成指導原則の各項目は、グッド・トランスペアレンシー・プラクティスを採用・推進する際に、考慮すべき事項であり、急速に進化する領域での継続的関与が、グッド・トランスペアレンシー・プラクティスおよびコンセンサス規格の協働型開発・実装・反復を周知する際に役立つとしている。
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク



