ワクチン接種で注射不要に、経粘膜抗原取り込みに直接関わる分子を同定:医療技術ニュース
東京大学は、粘膜面からの抗原取り込み口であるM細胞の機能発現に直接関わる分子として、Aif1を同定した。経粘膜ワクチンデリバリー法の構築につながると期待される。
東京大学は2017年2月22日、粘膜面からの抗原取り込み口であるM細胞の機能発現に直接関わる分子として、Allograft inflammatory factor 1(Aif1)を同定したと発表した。同大学医科学研究所の清野宏教授と大阪大学微生物病研究所の佐藤慎太郎特任准教授らの研究グループによる成果で、詳細は英科学誌「Nature Communications」のオンライン版に公開されている。
粘膜免疫における抗原提示は、主に粘膜組織に存在する粘膜関連リンパ組織(MALT)の中で行われ、粘膜面や管腔内から直接抗原を取り込む。この役割(トランスサイトーシス)を主に担っているとされるのが、MALTを覆う濾胞関連上皮細胞層(FAE)の中にある上皮細胞の一種のM細胞だ。これまで、M細胞への分化に必要な転写因子や、M細胞上の病原性細菌に対する受容体は報告されているが、トランスサイトーシスにおいて働く分子群は同定されていなかった。
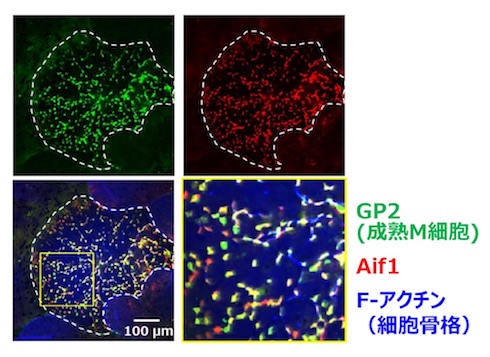
研究グループは今回、このM細胞のトランスサイトーシスに直接関与する分子群を同定することを目指した。まず、M細胞のほとんどを欠失したSpi-B欠損マウスとそのコントロールマウスのFAEを調整して遺伝子発現を解析・比較した。その中の候補遺伝子の1つとしてAif1を同定した。リアルタイムPCRを用いた実験から、Aif1は腸管上皮細胞系列においてはM細胞特異的発現分子であることが明らかになった。
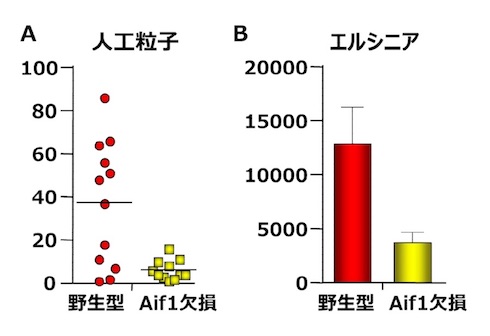
さらに、Aif1の生体内での機能を詳細に解析するために、Aif1を欠損するマウスを作製した。このマウスでは、M細胞の発達・分化に影響はなかったが、人工粒子や腸内共生細菌、病原性細菌のエルシニア・エンテロコリティカの取り込みが明らかに減弱しており、Aif1がM細胞の機能に関わっていることが示された。
また、さらなる実験・解析を行い、抗原の取り込みには、マクロファージや樹状細胞などの血球系細胞の影響はほとんどなく、M細胞中でAif1が発現し機能することが重要だということが分かった。
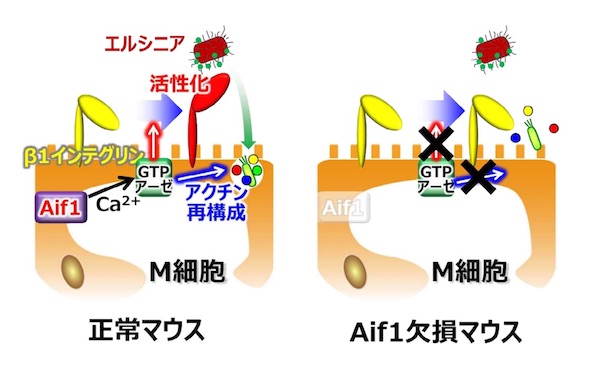
Aif1-Rac2のシグナル伝達がβ1インテグリンの活性化に寄与するなど、M細胞のトランスサイトーシスを実現するのに必須なものであることが示唆された。カルシウムイオン結合能を持つAif1は、カルシウム依存的なスモールGTPアーゼを活性化させ、それがM細胞の管腔側でβ1インテグリンを活性化し、エルシニアの受容体として機能させるとともに、アクチン再構成を引き起こし、管腔側の細胞膜が変化してトランスサイトーシスを誘導すると考えられるという。
今後、Aif1の発現や機能をコントロールすることができれば、注射器・針の必要のない粘膜型ワクチンの開発に向けて、抗原取り込み効率を上げることや、病原性微生物の侵入を阻止し感染を予防することが可能になるとしている。さらに、経粘膜ワクチンデリバリー法の構築につながると期待される。
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 早期乳がんに対する根治的重粒子線治療の有効性と安全性を確認
- すい臓がんの進行を抑制する遺伝子候補を発見
- 可食材料のみで構成した飲み込み型カプセルセンサーを開発
- 血液検査で認知症の予兆をキャッチする技術を開発
- 「週1回のチーズ」で認知症リスクが低下、明治らが1万人超の追跡調査で解明
関連記事
 運転能力を低下させる白質病変、東京大学らが実車実験で確認
運転能力を低下させる白質病変、東京大学らが実車実験で確認
東京大学と高知工科大学は、医学的に症状のない軽度の大脳白質病変(以下、白質病変)と診断された高齢の運転者は、そうでない高齢の運転者に比べて、運転能力が低下していることが実車実験で確認できた、と発表した。 貼るだけで皮膚がディスプレーになる極薄の超柔軟有機LEDを開発
貼るだけで皮膚がディスプレーになる極薄の超柔軟有機LEDを開発
東京大学は、大気中で安定して動作する、超柔軟で極薄の有機LEDを開発した。貼るだけで皮膚がディスプレーになるほか、有機光センサーと共に集積化することで、貼るだけで血中酸素濃度や脈拍の計測ができる。 血液透析の穿刺に最適なヘッドマウントディスプレイが単眼式になった理由
血液透析の穿刺に最適なヘッドマウントディスプレイが単眼式になった理由
ブラザーのヘッドマウントディスプレイ「エアスカウター」の医療用モデルは、東京大学医学部附属病院との共同研究によって生み出された製品だ。超音波検査装置の画像を見ながら血液透析のための血管に針を刺す(穿刺する)のに使いやすくするため、さまざまな改良が施されている。 ゲノム編集を青色の光で自在に制御する技術を開発
ゲノム編集を青色の光で自在に制御する技術を開発
東京大学は、「ゲノム編集」と呼ばれる遺伝子の改変操作を、光で自在に制御する技術を開発した。光スイッチタンパク質を用いることで、CRISPR-Cas9システムのDNA切断酵素の活性を青色の光で制御した。 GABA受容体運搬に関わるタンパク質が自閉症の原因遺伝子であることを特定
GABA受容体運搬に関わるタンパク質が自閉症の原因遺伝子であることを特定
東京大学は、脳の神経細胞の活動を抑えるGABA受容体の運搬に関わるタンパク質「PX-RICS」が、ヤコブセン症候群患者に発症する自閉症の原因であることを特定した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
コーナーリンク