多様なウイルスを防御、弱毒生ワクチンの経鼻感染の有効性を確認:医療技術ニュース
理化学研究所は、弱毒生ワクチンを経鼻感染させると、さまざまなウイルス株に対して感染を防御できる広域中和抗体が産生されるメカニズムを解明した。
理化学研究所は2021年7月15日、接種したウイルス株に対して有効な不活化ワクチンと異なり、弱毒生ワクチンを経鼻感染させると、さまざまなウイルス株に対して感染を防御できる広域中和抗体が産生されるメカニズムを解明したと発表した。これは同研究所と東京理科大学を中心とする共同研究グループによる成果だ。
→特設サイト「新型コロナウイルス 製造業が直面する未曾有の試練」
一般的にインフルエンザ予防に用いられるのは、病原性をなくした不活化ワクチンだ。接種したウイルス株に対して有効性が高いものの、新型インフルエンザなど構造の異なるウイルス株に対しては効果が低い。
一方で、弱毒化させたウイルスを用いる生ワクチンを経鼻投与した場合、新型インフルエンザに対しても有効であることが報告されている。このことから、弱毒生ワクチンによって、さまざまなウイルス株に対しても感染を防御できる広域中和抗体が産生されている可能性が考えられてきた。
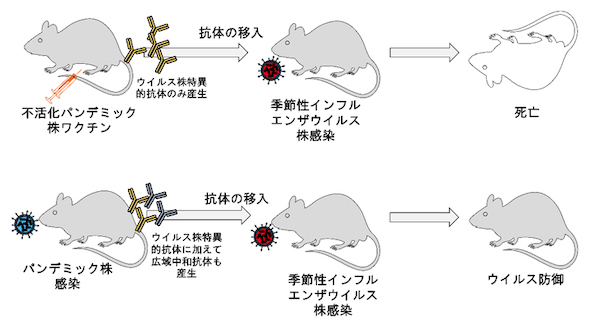
今回の研究では、2009年にパンデミックを引き起こしたインフルエンザウイルス株から作製した不活化ワクチンをマウスに接種した。別のマウスには、生きているパンデミック株を経鼻投与した。その後、それぞれのマウスから抗体を分離して、別のマウスに移入し、毎年のインフルエンザウイルス感染の原因となっている季節性インフルエンザウイルスに感染させた。
その結果、不活化ワクチン接種により産生した抗体を持つマウスは死亡したが、生きたパンデミック株の抗体を移入したマウスは季節性インフルエンザウイルスを防御し、広域中和抗体を産生していることが示された。
次に、ウイルス感染により広域中和抗体が産生するメカニズムを、ウイルスの侵入経路とウイルス複製の2つの点から調べた。ウイルスの侵入経路は経鼻で統一した。
生きたパンデミック株ウイルスを、ウイルスを複製しないTmprss2欠損マウスに感染させたところ、広域中和抗体は産生されなかった。また、その抗体を移入したマウスは季節性ウイルス株に対する抵抗性を示さなかった。
一方、生きたパンデミック株を感染させた野生型マウスでは、抗原に特異的な抗体分子を産生するB細胞で、パンデミック株と季節性ウイルス株に共通する抗原部位(エピトープ)を認識する抗体が産生されていた。
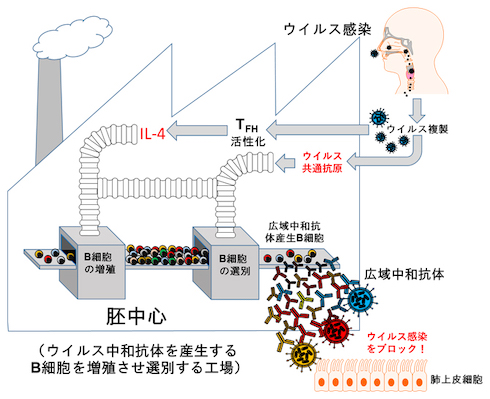
続いて、ウイルスの複製と広域中和抗体の関係を解明するため、リンパ節の中でもB細胞の増殖や選別を担う「胚中心」と、細胞間で情報をやりとりするインターロイキン-4(IL-4)などを産生して、B細胞の抗体産生を補助する「濾胞製ヘルパーT細胞(TFH細胞)」について、これらを持たないマウスに生きたパンデミック株を感染させた。その結果、広域中和抗体は産生されなかった。
さらに、ウイルス感染した野生型マウスではTFH細胞が顕著に活性化していたこと、B細胞の増殖を促進するIL-4を持たないマウスは胚中心が形成不全となり、広域中和抗体がほとんど産生されなかったことから、ウイルス感染時に産生される抗体の多様性を広げる上で、IL-4の働きが重要であることが分かった。
これらの成果から、生きたウイルスが鼻から侵入して感染すると、TFH細胞が活性化してIL-4を誘導し、胚中心でB細胞が増殖することが分かった。その後ウイルス株に共通するエピトープを認識するB細胞が選別され、広域中和抗体が産生するというメカニズムが解明された。
今回の研究で明らかになった、弱毒生ワクチンの有効性と広域中和抗体産生のメカニズムは、インフルエンザウイルスだけでなく、変異型新型コロナウイルスにも有効なワクチンを開発するための重要な知見といえる。
関連記事
- ≫特設サイト「新型コロナウイルス 製造業が直面する未曾有の試練」
 新型コロナウイルスが紫外線により不活化する原因を解明
新型コロナウイルスが紫外線により不活化する原因を解明
理化学研究所、日本大学、東京大学は、新型コロナウイルスが紫外線照射により不活化する原因は、ウイルスRNAの損傷にあることを発見した。紫外線照射前後で、ウイルスの形態やタンパク質量に変化はなかった。 ワクチン接種の「打ち手不足」解消に貢献、3Dプリンタ製筋肉注射練習モデル公開
ワクチン接種の「打ち手不足」解消に貢献、3Dプリンタ製筋肉注射練習モデル公開
慶應義塾大学SFC研究所は、同大学 看護医療学部 准教授の宮川祥子氏が推進するプロジェクトが、3Dプリンタ製筋肉注射練習モデルの設計データおよび作成/使用方法に関する説明書を特設Webサイトに公開したことを発表した。ワクチン接種の打ち手不足解消に向け潜在看護師の実技練習環境の整備を支援する。 ワクチン充填を効率化し、ミスを低減する支援機器を発売
ワクチン充填を効率化し、ミスを低減する支援機器を発売
三田理化メディカルは、新型コロナワクチンの充填手技を効率化する機器「クイックフィラー」の一般販売を開始した。薬瓶を逆さに保持して、ゴム栓や針先が確認しやすい設計になっているため、充填操作や計量が簡単になり、確実性が高まる。 内視鏡検査時の飛沫拡散を防御するマスクを開発
内視鏡検査時の飛沫拡散を防御するマスクを開発
名古屋大学は、内視鏡検査時の感染リスクを低減するマスクを開発した。気管支鏡などの内視鏡検査時に患者が装着することで、飛沫拡散を防止する。「Kenz e-mask」という名称で、2021年11月に発売予定だ。 新型コロナウイルスのデルタ株は、日本人の免疫から逃れる変異を持つ
新型コロナウイルスのデルタ株は、日本人の免疫から逃れる変異を持つ
東京大学は、新型コロナウイルスのデルタ株とイプシロン株に共通する変異が、日本人に多く見られる細胞性免疫「HLA-A24」から逃れることを発見した。さらに、ウイルスの膜融合性を高めることで、感染力が増強する。 新型コロナウイルス肺炎の画像診断を支援するソフトウェアを発売
新型コロナウイルス肺炎の画像診断を支援するソフトウェアを発売
富士フイルムは、AIを活用した新型コロナウイルス肺炎の診断支援ソフトウェア「COVID-19肺炎画像解析プログラム」を開発した。胸部CT画像を自動解析し、新型コロナウイルス肺炎に特徴的な画像所見が含まれる可能性を3段階で表示する。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク