「Apple Watch Series 4」の心電図アプリはFDA認証をどうやって取得したのか:海外医療技術トレンド(39)(1/3 ページ)
グローバルプラットフォーマーのウェアラブル型医療機器市場参入の裏側には、規制当局からイノベーション当局へのトランスフォーメーションをめざすFDAの政策がある。
「Apple Watch Series 4」向けアプリで利用されたDe Novo分類申請
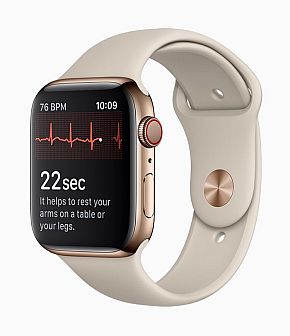 図1 心電図(ECG)アプリケーション機能を搭載した「Apple Watch Series 4」(クリックで拡大) 出典:出典:Apple「Apple Watch Series 4: Beautifully redesigned with breakthrough communication, fitness and health capabilities」(2018年9月12日)
図1 心電図(ECG)アプリケーション機能を搭載した「Apple Watch Series 4」(クリックで拡大) 出典:出典:Apple「Apple Watch Series 4: Beautifully redesigned with breakthrough communication, fitness and health capabilities」(2018年9月12日)本連載第37回で取り上げたグローバルプラットフォーマーのアップル(Apple)は、2018年9月12日、心電図(ECG)アプリケーション機能を搭載した「Apple Watch Series 4」を発表した(図1、関連情報)。
新製品発表の前日の9月11日、米国食品医薬品局(FDA)の医療機器・放射線保健センター(CDRH)は、同年8月14日にアップルから受理したECGアプリケーションに関する「De Novo分類申請」について、「クラスII」の「一般(OTC)用心電計ソフトウェア」に該当するという判断結果を通知している(関連情報、PDF)。
アップルが利用したDe Novo申請制度は、21世紀医療法や改正連邦食品医薬品化粧品法(FD&C Act)に基づき、リスクが軽度から中程度(クラスIからクラスII)の新しい医療機器で、比較対象となる同等の機器が存在しない場合に選択できる審査方法である(関連情報)。
具体的な内容については、FDAが、2015年4月13日に公表した「生命に重大な影響があるまたは不可逆的に衰弱させる疾患のアンメット・メディカル・ニーズを目的とする市販前承認への迅速なアクセスとDe Novo医療機器−業界および食品医薬品局スタッフ向けガイダンス」で概説されている(関連情報、PDF)。
2016年12月13日には、21世紀医療法に基づく「画期的機器(Breakthrough Devices)プログラム」が追加され、2017年10月25日には「画期的機器プログラム−業界および食品医薬品局スタッフ向けガイダンス草案」が公表された(関連情報、PDF)。
さらに、2018年9月6日には「医療機器市販前承認、De Novo分類、人道機器適用免除におけるベネフィット−リスク決定の不確実性の考慮−業界および食品医薬品局スタッフ向けガイダンス草案」が公表されている(関連情報)。ここでFDAは、負担を最小限に抑えながら、高い予測可能性や一貫性、効率性を保証することを目的として、不確実性を決定する際に考慮すべきファクターを例示している。
日本国内では、厚生労働省/医薬品医療機器総合機構(PMDA)が、「生命に重大な影響があり、既存の治療法等に有効なものがない疾患を対象とする革新的な医療機器について、その臨床開発に著しい困難を伴うと認められる場合に、医療機器のリスクとベネフィットのバランスを図りつつ、早期の実用化を促進する」ことを目的として、革新的医療機器条件付早期承認制度(関連情報)を設けている。残念ながら、実用化までこぎつけた画期的な医療機器製品の量では、米国が圧倒しているのが実情だ。
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 錠剤内部を透視するNIR検査装置を開発、1時間当たり最大25万錠を処理
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
コーナーリンク