合成生物学的手法により家族性アルツハイマー病特有の老人斑を再現:医療技術ニュース
理化学研究所らは、家族性アルツハイマー病で観察される老人斑を再現するアミロイド線維を化学的に作成し、解析した。同疾病の病態、進行を大きく変え、創薬開発にもつながる先駆的な研究成果だ。
理化学研究所は2024年8月30日、家族性アルツハイマー病(AD)で観察される綿花状の老人斑を再現するアミロイド線維を化学的に作成し、同繊維の凝集体に含まれる新規構造モチーフを発見したと発表した。東京工業大学らとの国際共同研究による成果だ。
遺伝子変異を伴うADである家族性ADのうち、β-アミロイド(Aβ)の22番目のアミノ酸であるグルタミン酸がグリシンに変異(E22G変異)したサブタイプは、綿花状の巨大な老人斑など特異的な病態を示す。また、この綿花状老人斑の構造は、脳内に存在するAβ40(40アミノ酸から成るAβ)の線維を中心として、Aβ42とAβ40の線維がリング状に形成されている。
研究グループはまず、作成条件を最適化してE22G変異を持つAβ40を化学合成し、従来法では不可能だった均一構造を持つE22G Aβ40の単離に成功した。単離されたE22G Aβ40線維は、複数線維が束を作る通常のAβと異なり、分散性が高く1本ずつ分離していることが明らかとなった。
分散性が高いため、E22G Aβ40線維の大きさは、同じ重量の変異を持たないAβと比べて約12倍大きく、凝集体の密度は低かった。他にE22G Aβ40線維は、ADの老人斑検出に用いるピッツバーグ試薬と同じ分子骨格を持つ試薬への反応が低く、この特徴も綿花状老人斑で観測されるアミロイド線維の多くの特徴と一致していた。
 E22G Aβ40線維が作る密度の低い凝集体。上段:(a)線維なしの試料。(b)対照試料としての、アミノ酸変異を持たない野生型(WT)Aβ40線維。(c)最適化して作成したE22G Aβ40線維。下段:(b)(c)を同じ倍率で拡大した画像 出所:理化学研究所
E22G Aβ40線維が作る密度の低い凝集体。上段:(a)線維なしの試料。(b)対照試料としての、アミノ酸変異を持たない野生型(WT)Aβ40線維。(c)最適化して作成したE22G Aβ40線維。下段:(b)(c)を同じ倍率で拡大した画像 出所:理化学研究所次に、クライオ電子顕微鏡と固体NMRで統合構造解析を試みたところ、E22G Aβ40はβシートがW字型に折り畳まれた新規の構造モチーフを持つことが明らかとなった。C末端の40番目のアミノ酸が他の残基と強く相互作用していないため、Aβ42がE22G Aβ40線維の末端に吸着したときにC末端の41と42残基がじゃまにならず、相互作用できることで、Aβ42の共凝集を引き起こしやすいことが示唆された。
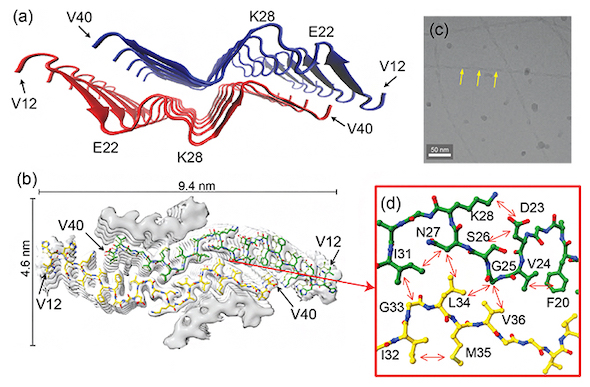 W字型にβシートが折り畳まれた新規構造モチーフ。(a)W字型の新規構造モチーフを示すE22G Aβ40線維の構造。(b)クライオ電子顕微鏡で得られた密度マップ(分子内部密度の高低を白と灰色のアウトラインで表示)と得られた構造(緑と黄色の構造)の重ね合わせ。(c)クライオ電子顕微鏡で得られた線維の画像。(d)クライオ電子顕微鏡で得られた構造に、固体NMRで観測された原子間の相互作用情報(矢印)を重ね合わせたもの[クリックで拡大] 出所:理化学研究所
W字型にβシートが折り畳まれた新規構造モチーフ。(a)W字型の新規構造モチーフを示すE22G Aβ40線維の構造。(b)クライオ電子顕微鏡で得られた密度マップ(分子内部密度の高低を白と灰色のアウトラインで表示)と得られた構造(緑と黄色の構造)の重ね合わせ。(c)クライオ電子顕微鏡で得られた線維の画像。(d)クライオ電子顕微鏡で得られた構造に、固体NMRで観測された原子間の相互作用情報(矢印)を重ね合わせたもの[クリックで拡大] 出所:理化学研究所凝集していない野生型Aβ42の単分子にE22G Aβ40繊維を混ぜると、野生型Aβ42の線維化が促進し、E22G Aβ40と野生型Aβ42が共凝集した。共凝集したキメラ線維もW字型構造で安定していた。このことから、E22G変異を伴う家族性ADでは、通常のADとは異なり、まずAβ40が線維化して大きなコアを形成し、その周囲でAβ42が共凝集し線維が蓄積することで、綿花状老人斑に特有のコア−シェル構造が生成すると考えられる。
今回の研究は、Aβ線維が凝集するメカニズムやその構造、差異を理解する助けとなるもので、ADの病態、進行を大きく変え、創薬開発に貢献する可能性を示している。
関連記事
 ドーパミンによるアミロイドβの分解機構を発見
ドーパミンによるアミロイドβの分解機構を発見
理化学研究所らは、アルツハイマー病の初期病理学的因子であるアミロイドβペプチドの分解酵素ネプリライシンが、ドーパミンにより制御されていることを発見した。 血液バイオマーカーにより、超早期段階の脳アミロイドPET検査結果を予測
血液バイオマーカーにより、超早期段階の脳アミロイドPET検査結果を予測
東京大学は、血液バイオマーカーを組み合わせることで、アルツハイマー病に特徴的な脳内アミロイドβの蓄積を検出するPET画像の結果を、超早期段階でも正確に予測できることを明らかにした。 アルツハイマー病など神経疾患領域での提携を拡大、検査試薬開発へ
アルツハイマー病など神経疾患領域での提携を拡大、検査試薬開発へ
富士レビオグループのFujirebio Diagnostics ABは、Beckman Coulterとの神経疾患領域における提携を拡大した。Beckman Coulterの高感度全自動化学発光酵素免疫測定装置「DxI 9000 Access Immunoassay Analyzer」向けに、検査試薬を開発する。 リストバンド型生体センサーを用いて脳内アミロイドベータの蓄積を予測
リストバンド型生体センサーを用いて脳内アミロイドベータの蓄積を予測
エーザイと大分大学は、リストバンド型生体センサーから取得した生体データを活用し、アルツハイマー病の病理である脳内アミロイドベータの蓄積を予測する機械学習モデルを開発した。 新型コロナからアルツハイマー病の神経細胞死を抑制するペプチドを開発
新型コロナからアルツハイマー病の神経細胞死を抑制するペプチドを開発
東京都立大学は、新型コロナウイルスのタンパク質Orf9bが、アルツハイマー病関連キナーゼMARK4の活性を非競合的に阻害することを発見した。また、Orf9bの配列から、細胞透過性MAPK4阻害ペプチドを開発した。 ハブ毒由来の酵素でアルツハイマー病のアミロイドβを分解することを発見
ハブ毒由来の酵素でアルツハイマー病のアミロイドβを分解することを発見
東北大学は、ハブ毒から精製した蛇毒メタロプロテアーゼがアルツハイマー病の原因となるアミロイドβを無害なペプチドに分解し、ヒト培養細胞からのアミロイドβ産生量を大幅に減少させることを発見した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
コーナーリンク
 合成生物学的なアプローチで作成したE22G Aβ40線維の透過電子顕微鏡像。(a)従来法で作成したE22G Aβ40線維。(b)条件を最適化して得られた線維 出所:理化学研究所
合成生物学的なアプローチで作成したE22G Aβ40線維の透過電子顕微鏡像。(a)従来法で作成したE22G Aβ40線維。(b)条件を最適化して得られた線維 出所:理化学研究所


