米国はバイデン政権へ移行、医療機器のイノベーション支援策はどうなるのか:海外医療技術トレンド(67)(1/3 ページ)
米国はトランプ政権から新たに大統領に就任するジョー・バイデン氏の次期政権に移行することとなった。医療機器のイノベーション支援策はどのような形で引き継がれるのだろうか。
本連載第27回で、米国のオバマ政権からトランプ政権への移行期における「21世紀医療法」起点のイノベーション推進策を取り上げた。あれから4年が経過し、米国はトランプ政権から新たに大統領に就任するジョー・バイデン氏の次期政権に移行することとなったが、医療機器のイノベーション支援策はどのような形で引き継がれるのだろうか。
COVID-19対応期の米国でも進むスタートアップ主導の医療機器開発
2020年12月30日、米国食品医薬品局(FDA)傘下の医療機器・放射線保健センター(CDRH)は、2020年1月1日〜12月28日の間の新型コロナウイルス感染症(COVID-19)対応状況について整理したインフォグラフィックを公表した(図1参照、関連情報)。
 図1 米国FDA医療機器・放射線保健センター(CDRH)のCOVID-19対応(クリックで拡大) 出典:FDA「Center for Devices and Radiological Health‘s Response to Coronavirus (COVID-19): Infographic」(2020年12月30日)
図1 米国FDA医療機器・放射線保健センター(CDRH)のCOVID-19対応(クリックで拡大) 出典:FDA「Center for Devices and Radiological Health‘s Response to Coronavirus (COVID-19): Infographic」(2020年12月30日)規制の柔軟性についてみると、FDAは、2020年に11件の緊急使用許可(EUA)テンプレートと26件のガイドライン類を発行している。特にEUAについてみると、1年間で608件の医療機器を承認している。このうち検査・収集キットは399件で、分子検査が235件、抗原検査が11件、抗体検査が63件となっている。なお、FDAが受け付けた事前EUA申請は1995件、EUA申請は3521件となっている。
本連載第27回と第39回で、21世紀医療法に基づく「デジタルヘルス・イノベーション行動計画」(2017年7月27日、関連情報、PDF)や、「画期的機器(Breakthrough Devices)プログラム−業界および食品医薬品局スタッフ向けガイダンス」(2018年12月18日最終版公表、関連情報)、「医療機器市販前承認、De Novo分類、人道機器適用免除におけるベネフィット−リスク決定の不確実性の考慮−業界および食品医薬品局スタッフ向けガイダンス」(2019年8月29日最終版、関連情報)を取り上げた。
2018年9月に承認されたアップルの「Apple Watch Series 4」向け心電図(ECG)アプリケーションで広く知られるようになったDe Novo分類申請は、COVID-19緊急対応の影響下でも堅調に推移している。FDAのDe Novo分類データベース(関連情報)によると、2019年1〜12月の間のDe Novo分類に該当する医療機器製品が総数23件であったのに対し、COVID-19緊急対応が続いた翌年の2020年1〜12月の間は、図2に示す通り、総数26件となっている。それらの開発元の大半を、新興のスタートアップ企業が占めている点が米国市場の特徴だ。
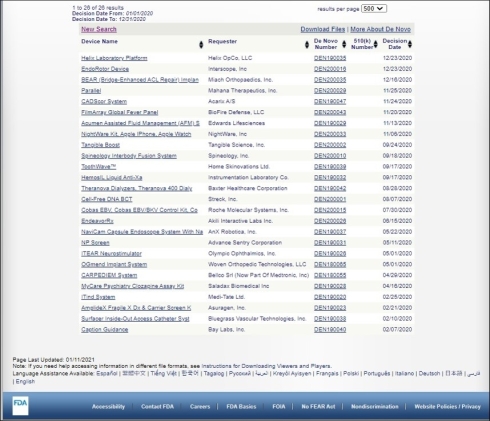 図2 米国FDAにおける2020年1〜12月のDe Novo分類医療機器一覧(クリックで拡大) 出典:FDA「Device Classification Under Section 513(f)(2)(De Novo)」(2021年1月11日時点)
図2 米国FDAにおける2020年1〜12月のDe Novo分類医療機器一覧(クリックで拡大) 出典:FDA「Device Classification Under Section 513(f)(2)(De Novo)」(2021年1月11日時点)Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
- ウシ由来の組織再生型靱帯で膝を切らずに再建、2028年実装目指す
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
コーナーリンク



