明るい場所と暗い場所、環境の変化に目が慣れる分子メカニズムを解明:医療技術ニュース
大阪大学は、明るい場所でも暗い場所でも、環境の変化に応じて適切に物体を見る機能(明暗順応)の分子メカニズムを明らかにした。今後、加齢黄斑変性や網膜色素変性症などの網膜変性疾患の治療薬の開発が期待される。
大阪大学は2019年11月7日、明るい場所でも暗い場所でも、環境の変化に応じて適切に物体を見る機能(明暗順応)の分子メカニズムを明らかにしたと発表した。同大学蛋白質研究所 教授の古川貴久氏らの研究グループによる成果となる。
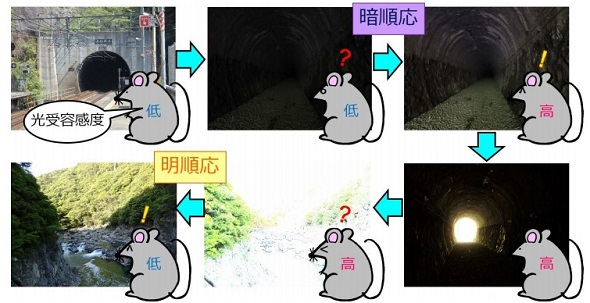
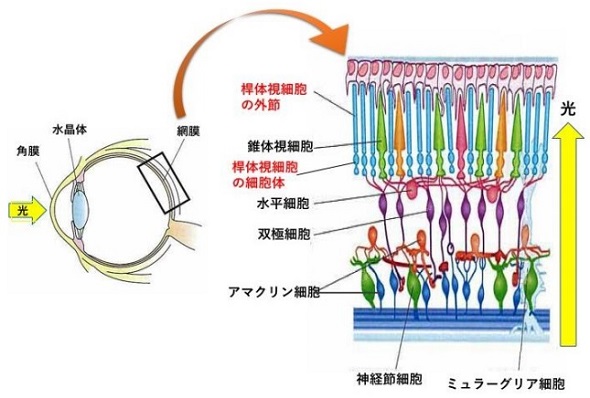
網膜で光を感知する細胞は視細胞と呼ばれ、暗い場所で働く桿体視細胞と明るい場所で働く錐体視細胞の2種類がある。このうち桿体視細胞は、暗い場所では光への感度を上昇させ、明るい場所では低下させる。この光に対する感度を上げ下げする明暗順応は視覚に重要な役割を果たしているが、桿体視細胞が光の強度に応じて光受容感度を制御する分子メカニズムは解明されていなかった。
今回、研究グループでは、光情報を伝えるタンパク質のトランスデューシンに着目した。桿体視細胞は、細胞の外側にある外節で光を受けると、トランスデューシンがより内側の細胞核がある細胞体へと情報を伝える。この光に依存したトランスデューシンの細胞内局在変化は、桿体視細胞の光受容感度を調節することが知られている。
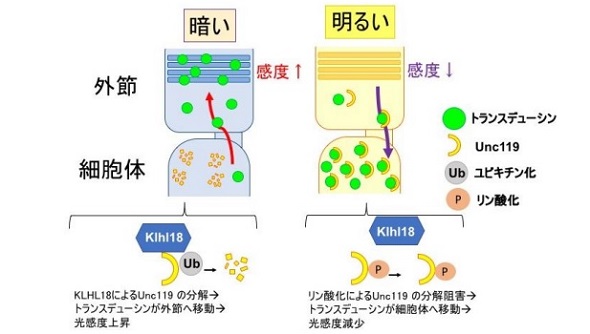
まず、視細胞の発生と機能に重要な分子の探索から、桿体視細胞にKlhl18というユビキチン化酵素が強く発現することを発見。さらに、Klhl18の働きにより、明暗に応じてトランスデューシンと結合するUnc119たんぱく質をユビキチン化して分解することで、トランスデューシンの細胞内局在の変化を制御することが明らかになった。
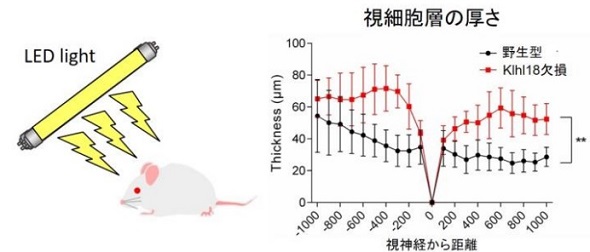
具体的には、桿体視細胞におけるUnc119の発現は、Klhl18に依存して暗い条件下では減少した。一方、明るい条件では、Klhl18によるUnc119の分解は、Unc119のリン酸化により抑制された。このことからKlhl18は、Unc119のユビキチン化による分解を引き起こし、Unc119に依存したトランスデューシンの視細胞外節と細胞体との間の局在変化、それに伴う光受容感度の上げ下げにより、明暗順応を制御していることが分かった。
これらの成果から、光の入力から蛋白質分解を経て、トランスデューシンの局在変化に至る明暗順応の一連の分子メカニズムが明らかになった。今後、加齢黄斑変性や網膜色素変性症などの網膜変性疾患の治療薬の開発が期待される。
関連記事
 脳細胞の活動を深層ニューラルネットワークに写し取る手法を開発
脳細胞の活動を深層ニューラルネットワークに写し取る手法を開発
東京大学は、目で見た画像に対して脳細胞がどのように活動するかを深層ニューラルネットワークに写し取る手法を開発した。脳内における感覚情報の処理機構の解明や、人間に近い振る舞いをする人工知能の作成につながることが期待される。 眼球はなぜ丸くなる? 形ができるメカニズムを解明
眼球はなぜ丸くなる? 形ができるメカニズムを解明
京都大学が、目の丸い形の元となる「眼杯組織」が作られる仕組みを解明した。この仕組みを活用することで、再生医療に必要な、試験管内での器官形成を制御できるようになる。 長期宇宙滞在で発生する眼球の変形、原因が大脳の移動だと明らかに
長期宇宙滞在で発生する眼球の変形、原因が大脳の移動だと明らかに
京都大学が、長期宇宙滞在後の宇宙飛行士に見られる、眼球の後ろが平たくなる眼球後部平たん化と、眼球とつながる視神経を取り囲む視神経鞘の拡大について、その本質的な病因を明らかにした。 ヒトはいつから高度な視覚を得たか、脊椎動物に近縁のホヤの眼で検討
ヒトはいつから高度な視覚を得たか、脊椎動物に近縁のホヤの眼で検討
京都大学は、脊椎動物に進化が近いホヤの眼で機能する光受容タンパク質を解析することで、ヒトの高度な視覚機能を支える光センサーがどのように進化してきたのかを明らかにした。 バイオレット光に近視進行の抑制効果を発見
バイオレット光に近視進行の抑制効果を発見
慶應義塾大学は、360〜400nmのバイオレット光が近視進行(眼軸長伸長)を抑制することを発見した。ヒヨコを用いた実験では、バイオレット光を浴びると近視進行を抑制する遺伝子が上昇することが明らかになった。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク