細胞と細胞を張り合わせるタンパク質の構造を原子レベルで解明:医療技術ニュース
名古屋大学は、X線結晶構造解析手法を用いて、細胞同士を密着させてバリアを形成するタンパク質の1種「クローディン3」の構造を原子レベルで明らかにした。
名古屋大学は2019年2月26日、細胞同士を密着させてバリアを形成するタンパク質「クローディン3」の構造を解明したと発表した。同大学細胞生理学研究センター 研究員の中村駿氏らと大阪大学の共同研究によるもので、クローディン3の形を原子レベルで明らかにした。
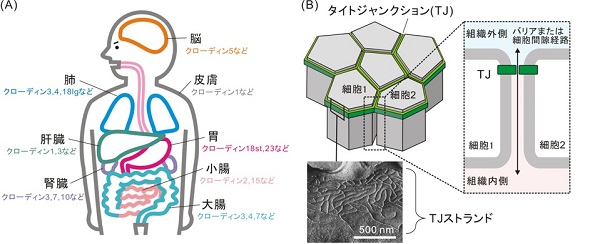
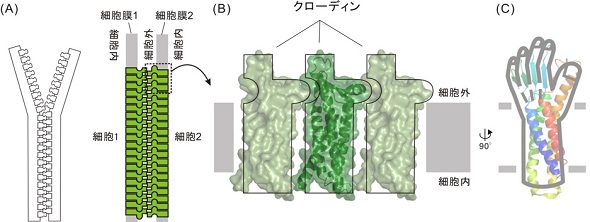
クローディン3は、皮膚や血液脳関門の形成など、生体内のバリア機能を担うタンパク質「クローディン」の1種だ。クローディン3の構造は、親指の付け根に当たる部分を起点とし、手首より上の部分に相当する細胞外領域が大きく屈曲していることが知られている。研究グループは今回、この屈曲した構造に着目した。
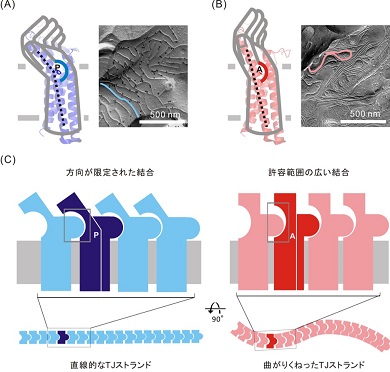
X線結晶構造解析という手法を用いてこの構造を観察したところ、屈曲の起点となる親指の付け根に相当する部分に、プロリンという種類のアミノ酸残基が存在しており、これが屈曲を引き起こしていると考察された。
そのため、プロリンを他のクローディンに存在するアラニンに置換したクローディン3を作製して観察した結果、屈曲は見られず、直線型の構造が見られた。つまり、クローディンの全体構造は、親指の付け根部分のアミノ酸残基の違いで屈曲型または直線型となり、手首の傾きが変わるように細胞外領域の傾きが変化することが分かった。
また、屈曲型クローディン3よりも直線型クローディン3の方が強い接着力を持ち、隣り合う細胞同士を密着させる接着装置「タイトジャンクション」の接着力に影響があることが明らかとなった。
今後は、特定器官のバリアを経由する新しい薬物送達法の開発などへの応用が期待される。
関連記事
 動物の体節が正確につくられる仕組み、体内時計が“いい加減”な細胞を指揮
動物の体節が正確につくられる仕組み、体内時計が“いい加減”な細胞を指揮
京都大学は、数理モデルと実験を組み合わせることで、体内時計が細胞同士を協調させて、体節を正確に作るメカニズムの一端を明らかにした。 AIによる画像認識技術を活用し、がん細胞の種類の判別に成功
AIによる画像認識技術を活用し、がん細胞の種類の判別に成功
大阪大学は、AI(人工知能)による画像判別技術を活用し、がん細胞の種類を判別することに成功した。人の目では判別困難な微細な差異を検出し、顕微鏡画像に写された細胞の種類を特定可能になった。 乾癬の原因は皮膚表面の細胞にあった、有効で安価な新薬の開発へ
乾癬の原因は皮膚表面の細胞にあった、有効で安価な新薬の開発へ
京都大学は、皮膚表面の表皮にある細胞内シグナル伝達物質「TRAF6」が、乾癬の発症や持続に必須であることを発見した。TRAF6が抗体医薬に代わる新しい治療の標的となり得ることが示された。 涙に含まれるコレステロール硫酸が眼を炎症細胞の浸潤から守る
涙に含まれるコレステロール硫酸が眼を炎症細胞の浸潤から守る
九州大学は、涙の中に含まれるコレステロール硫酸という脂質が、免疫細胞の動きに重要な「DOCK2」というタンパク質の機能を阻害し、眼を炎症細胞の浸潤から守る働きをしていることを発見した。 高濃度ビタミンCが、転移がん細胞の抑制に有効であることを発見
高濃度ビタミンCが、転移がん細胞の抑制に有効であることを発見
東京工科大学は、高濃度ビタミンC(VC)による、がん転移抑制メカニズムに関して新発見をしたと発表した。VCは血液を循環する転移がん細胞に対して、強い抑制作用があることが分かった。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク