秒速1000回転の細菌べん毛モーター、回転方向を制御するタンパク質の構造を解明:医療技術ニュース
名古屋大学は、核磁気共鳴法(NMR)と分子動力学計算法を用いて、細菌が持つ運動器官「べん毛モーター」を構成するタンパク質「FliG分子」の構造動態を解明した。
名古屋大学は2017年9月22日、核磁気共鳴法(NMR)と分子動力学計算法を用いて、細菌が持つ運動器官「べん毛モーター」を構成するタンパク質「FliG分子」の構造動態を解明したと発表した。FliGが複数の構造間を揺らぐことでべん毛モーターの回転方向変換を制御し、前進/後退を決定するために重要な役割を担っていることが分かった。
細菌のべん毛モーターは、50nm以下と小さいながら秒速200〜1000回転以上の速さで回転する生体ナノマシンとして注目される。同研究で明らかになったFliGcのダイナミックな構造変換が、高いエネルギー変換効率でモーターの回転方向を変換するためにも重要であることが予想される。この知見をもとに生物特有の回転方向制御機構が解明されれば、人工的にナノマシンを設計して自在に分子モーターを制御できるようになり、医療や人工生命設計など、さまざまな分野への応用が期待される。
FliGは、N末端ドメイン/中間ドメイン/C末端ドメインから構成される。同研究では、遺伝子組み換え技術により、海洋性ビブリオ菌に由来するタンパク質のC末端ドメイン(FliGc)とべん毛モーターの回転方向に異常を来すアミノ酸変異体を調製。NMRと分子動力学計算法を用いてそれらの構造情報を比較し、回転方向の変換制御を調査した。
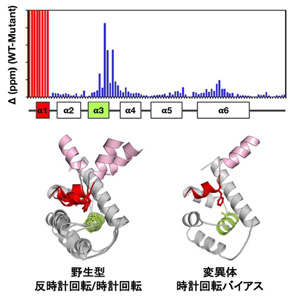
その結果、野生型FliGcは主に3つのコンフォメーションを形成し、それらの構造間を行き来する(揺らいでいる)ことが分かった。一方、べん毛の回転方向変換に異常を示す変異型FliGc(FliGc-A282T)では、複数のコンフォメーションは見られなかった。
FliGcには、3つのαヘリックスからなるC1ドメインと、6つのαヘリックスで構成されるC2ドメインが存在する。C2ドメインの1番目のヘリックス(α1ヘリックス)は、C1ドメインとC2ドメインをつなぐ“ちょうつがい”として働く。これがFliGcの構造に複数の表情を生み出していることから、べん毛モーターの回転方向の変換に関わっていることが明らかとなった。
同研究は、同大学大学院 理学研究科付属構造生物学研究センター 教授の本間道夫氏らと、長浜バイオ大学バイオサイエンス学部 教授の白井剛氏、横浜国立大学大学院工学研究院 教授の児嶋長次郎氏らの共同研究グループによるもの。成果は同月14日に米科学誌「Structure」電子版で公開された。
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- ナノイー技術で花粉症状を緩和、パナソニックがヒト臨床試験で実証
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
関連記事
 心臓での抗がん剤の副作用を再現、微細加工技術応用のマイクロ流体デバイスで
心臓での抗がん剤の副作用を再現、微細加工技術応用のマイクロ流体デバイスで
京都大学は、微細加工技術を駆使した生体外ヒトモデル「Body on a Chip」の開発に成功した。患者や健常者、実験動物などに頼ることなく、薬の効能・効果や毒性を評価できる。 微細加工技術を医療に生かす、アルプス電気のマイクロ流路
微細加工技術を医療に生かす、アルプス電気のマイクロ流路
アルプス電気は「MEDTEC Japan 2014」で、マイクロ流路などを医療向けに提案した。微細加工が必要なもので、同社が電子部品で培ってきた金型微細加工技術を、医療分野にも応用したい考えだ。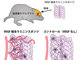 脳梗塞領域に血管を誘引する人工細胞足場、脳の修復や再生に寄与
脳梗塞領域に血管を誘引する人工細胞足場、脳の修復や再生に寄与
東京医科歯科大学は、脳梗塞領域に血管を誘引するスポンジ形状の人工細胞足場を開発した。一度損傷を受けると再生しないとされていた脳の修復/再生に寄与する成果で、再生医療への展開が期待される。 がん組織周辺で抗がん剤を合成・放出する糖鎖高分子ベシクルを開発
がん組織周辺で抗がん剤を合成・放出する糖鎖高分子ベシクルを開発
京都大学は、物質透過性を持つ糖鎖高分子ベシクルを開発した。がん組織周囲で抗がん剤を合成し、放出する医療ナノデバイス(ナノファクトリー)として機能する、初めての材料となる。 人工生体ナノマシン設計につながるべん毛モーターのタンパク質構造を解明
人工生体ナノマシン設計につながるべん毛モーターのタンパク質構造を解明
名古屋大学は、細菌が持つ運動器官べん毛モーターを構成するタンパク質の1つ、MotA分子の立体構造を解明したと発表した。将来的に人工生体ナノマシンの設計や医療・機械工学分野などへの応用が期待される成果だという。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
コーナーリンク
 前進と後退時のモータークラッチ部位構造 出典:名古屋大学
前進と後退時のモータークラッチ部位構造 出典:名古屋大学


