失明を招く加齢黄斑変性の病態を生体組織チップ上で一部再現、東北大学:医療技術ニュース
東北大学は、失明につながる網膜疾患の病態の一部を生体組織チップ上で再現することに成功した。疾患モデル動物の代替として、病態解析や創薬スクリーニングに応用できる可能性がある。
東北大学は2017年6月15日、失明につながる網膜疾患の病態の一部を生体組織チップ上で再現することに成功したと発表した。同大学大学院 工学研究科 准教授の梶弘和氏らが、同医学系研究科 教授の阿部俊明氏らと共同で行ったもので、成果は英科学誌「Scientific Reports」電子版に6月14日付で掲載された。
今回発表した研究では、滲出型加齢黄斑変性の主要な病態である新生血管の発生を一部再現した。疾患モデル動物の代替として病態解析や創薬スクリーニングに応用できる可能性があるという。
同研究では、眼底構造(網膜の一番外側の構造)を模倣して、ヒト由来の網膜色素上皮(RPE)細胞と血管内皮細胞を、3次元マイクロ流路デバイス内に配置/培養する実験を行った。この3次元マイクロ流路デバイスは、2層式のマイクロ流路から成り、各流路がポーラス膜(多孔質の膜)で隔てられている。細胞周囲環境を制御して、両細胞間の相互作用を検討した。
まず、片方のマイクロ流路にRPE細胞を導入して、ポーラス膜上で単層組織を形成させた後、もう片方のマイクロ流路に血管内皮細胞を導入し、RPE層の反対側のポーラス膜に血管内皮細胞を接着させて共培養系を作製。この状態でも、血管内皮細胞がポーラス膜を通過してRPE層側に移動する様子が多少観察されたが、さらに、RPE層側に低グルコース負荷や疑似低酸素負荷を与えると、RPE層側に移動する血管内皮細胞の数が増加し、RPE層の崩壊面積も増加した。
RPE細胞を単培養した場合、低グルコース負荷や疑似低酸素負荷を与えると、RPE細胞から血管内皮成長因子(VEGF)の分泌量が増加するため、この血管内皮細胞の動きは、RPE細胞が分泌したVEGFによるものと考えられる。また、低グルコース負荷や疑似低酸素負荷ではRPE層の崩壊は認められなかったことから、RPE層側に移動した血管内皮細胞がRPE層を崩壊させたと考えられる。
今後、血管内皮細胞の毛細血管網化や神経網膜を追加することで、より生体機能に近い生体組織チップの開発が見込まれる。また、患者iPS由来の成熟分化細胞を用いることで、個々の患者に合せた治療法の開発や創薬スクリーニングへの発展も期待される。
網膜疾患に対する医薬品候補化合物の評価には、疾患モデル動物が使われているが、ヒトとの種差があるため結果の信頼性が必ずしも高いわけではなく、コスト面/倫理面などの課題もあった。
関連記事
 眼球内の血管が自発的に退縮するメカニズムを解明
眼球内の血管が自発的に退縮するメカニズムを解明
慶應義塾大学は、マウスを用いて硝子体血管を明瞭に可視化する技術を確立し、血管が自発的に退縮するメカニズムを明らかにした。この研究成果は先天性眼科疾患の病因解明や、腫瘍を血行不全に陥らせる新しいがん治療法の開発にもつながるという。 最短約3秒の検査で網膜の血管形態を描出する画像処理技術
最短約3秒の検査で網膜の血管形態を描出する画像処理技術
キヤノンは、造影剤を用いず、最短約3秒の検査で網膜の血流の状態を可視化し、血管形態を描出する画像処理技術「OCT Angiography」のオプションソフトウェアを発売する。高画質での3D表示が可能で、眼底疾病の応用検査への活用が期待される。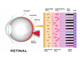 視細胞を制御するソフトウェアを視覚再生医療に提供
視細胞を制御するソフトウェアを視覚再生医療に提供
JIG-SAWとモビコムは、ソフトウェアで視細胞を制御する「視覚再生医療」に着手した。視覚再生用のプリズムグラスと視細胞制御ソフトウェアを提供する。 近視の発症に関わる遺伝子変異を発見、治療薬開発に期待
近視の発症に関わる遺伝子変異を発見、治療薬開発に期待
京都大学大学院医学研究科の山城健児講師と吉村長久教授らは、近視(近眼)および強度近視の発症に関わる遺伝子変異を発見した。9800人の日本人データを解析することで、WNT7B遺伝子の変異(SNP)が近視の発症に影響を与えていることを明らかにした。 もはやSFではない“サイボーグ”技術
もはやSFではない“サイボーグ”技術
米国の人気SFテレビドラマ「600万ドルの男」や「地上最強の美女バイオニック・ジェミー」の主人公達のように、人体の機能を電子機器によって代替する、いわゆる“サイボーグ”技術の実用化が進んでいる。本稿では、人工網膜と人工内耳に関する米国の最新研究事例を紹介するとともに、それらに活用されている電子技術について解説する。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク
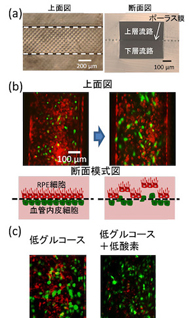 マイクロ流路デバイス内でのRPE細胞と血管内皮細胞の共培養 出典:東北大学
マイクロ流路デバイス内でのRPE細胞と血管内皮細胞の共培養 出典:東北大学


