廃棄物を最小限に抑えた効率的なアルキル化反応技術を開発:研究開発の最前線
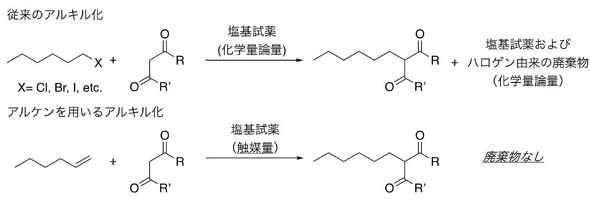
東京大学は、脱離基を持たない炭化水素原料を用いて、カルボニル基α位での炭素−炭素結合生成反応に成功した。既存の手法で多量に発生していた塩基試薬や脱離基由来の廃棄物を大幅に削減できる。
東京大学は2023年10月11日、脱離基を持たない炭化水素原料を用いて、カルボニル基α位での炭素−炭素結合生成反応(アルキル化反応)に成功したと発表した。既存の手法で多量に発生していた塩基試薬や脱離基由来の廃棄物を大幅に削減できる。
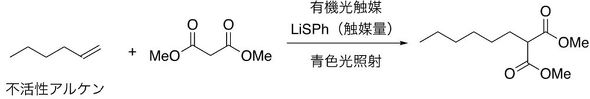
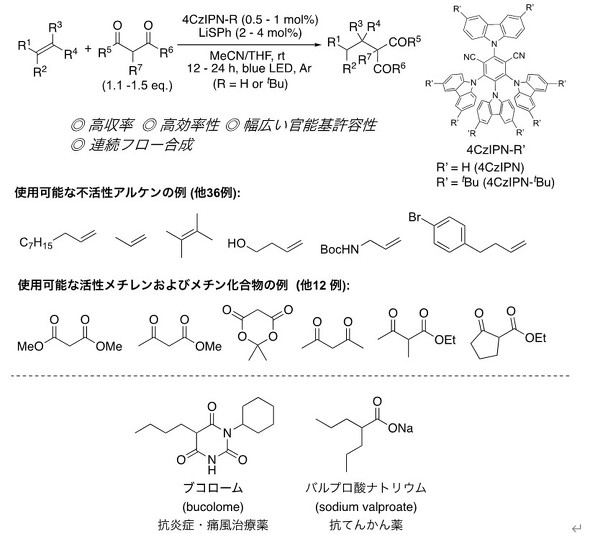
実験では、活性メチレン化合物のマロン酸ジメチルを原料として使用し、不活性アルケンの1-デセンとの反応を検討。有機光触媒として、2、4、5、6-テトラキス(9H-カルバゾール-9-イル)イソフタロニトリル(4CzIPN)とリチウムチオフェノキシド(LiSPh)を用いた場合、青色光照射下でアルキル化反応がスムーズに進行することを確認した。
また、反応条件を最適化したところ、アセトニトリル(MeCN)-テトラヒドロフラン(THF)混合溶媒の使用が適切であることが分かった。触媒量も、光触媒を0.5mol%、LiSPhを2mol%まで抑えても反応を進行できた。
この反応は低触媒量で進行し、かつ不活性アルケンに対する活性メチレン化合物の量も小過剰で済むため効率的だ。幅広い原料を利用でき、さまざまな官能基の炭化水素化合物(アルケン)に対して有効で、連続フロー合成も適用できる。
医薬品の合成実験では、抗炎症、痛風治療薬のブコロームや抗てんかん薬のバルプロ酸ナトリウムを効率的に合成できた。
今後、医薬品や農薬、機能性化学品の合成において、廃棄物を最小限に抑えた効率的なプロセス開発への応用が期待される。
関連記事
 両面ゲートIGBTのスイッチング損失を最大62%低減、東京大学が新技術開発
両面ゲートIGBTのスイッチング損失を最大62%低減、東京大学が新技術開発
東京大学 生産技術研究所は2020年12月7日、ゲート両面の動作タイミングを最適化することなどを通じて、両面ゲートIGBTのスイッチング損失を、片面ゲートIGBTと比較して最大62%低減することに成功したと発表。 東大とIBMが産学連携を加速する量子コンピュータ研究施設を設立
東大とIBMが産学連携を加速する量子コンピュータ研究施設を設立
東京大学と日本IBMは2021年6月7日、量子コンピュータ技術の研究開発を行うハードウェアのテストセンターとして「The University of Tokyo - IBM Quantum Hardware Test Center≫」を東京大学 浅野キャンパス内(東京都文京区)に開設したことを発表した。 “軽やかな”耐震補強を実現するカーボンファイバー、建築でも採用広がる
“軽やかな”耐震補強を実現するカーボンファイバー、建築でも採用広がる
小松精練と東京大学 工学部 建築学科 隈研吾研究室は、東京大学構内でイベント「この先に繋げる都市環境のアイディア」を開催。新たな建築材料として、カーボンファイバーによる耐震補強などについて紹介した。 データ駆動による完全循環型バイオアダプティブ材料の開発を推進
データ駆動による完全循環型バイオアダプティブ材料の開発を推進
日立製作所は、再資源化可能な完全循環型バイオアダプティブ材料の開発に向けて、東京大学と協創すると発表した。東京大学の実験データやノウハウを、同社のMI向けAI技術により分析することで、データ駆動による開発を推進する。 経済合理性あるサーキュラーエコノミーの実現を、三菱電機と東大が研究講座開設
経済合理性あるサーキュラーエコノミーの実現を、三菱電機と東大が研究講座開設
三菱電機は東京大学大学院工学系研究科と共同で、サーキュラーエコノミーの実現に向けた課題解決を目指す社会連携講座「持続可能な循環経済型未来社会デザイン講座」を開設した。 鉄スクラップ検収をAIで効率化、低CO2排出の電炉法の活用拡大へ
鉄スクラップ検収をAIで効率化、低CO2排出の電炉法の活用拡大へ
トピー工業は東京大学発のスタートアップEVERSTEELと共同で鉄スクラップをAIで解析する実証実験を開始した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
素材/化学の記事ランキング
- トヨタのEVに載る全固体電池向け固体電解質の大型製造装置を建設
- レアメタルを使わないシリコーン硬化用の鉄触媒を開発
- 富士フイルムが営業利益で過去最高、「半導体材料」と「チェキ」好調
- エンプラが半導体製造装置用途で堅調も三菱ケミカルGは減収減益、要因とは
- 厚さ200μmで柔らかくのりのはみ出しが少ないバックグラインドシート
- 10万原子のシミュレーションを1週間で、富士通MI技術の「異次元の高速化」
- ペロブスカイト太陽電池の高効率化と高耐久化を実現する添加剤を発売
- エネルギー消費量を最大75%削減する平膜型排水処理技術の確立にめど
- 車載向け全固体電池に絶妙な圧力で、固体電解質と電極をつなぐ緩衝材
- 商業スケールでPMMAケミカルリサイクル技術のライセンス提供開始
コーナーリンク