「腸の法則」に捉われない小腸細胞群の電位協調をイメージ解析で立証:医療技術ニュース
名古屋大学は、小腸微小領域に内在するペースメーカー細胞群が、「腸の法則」に捉われない自由な自発性電位連携を創り出すことをイメージ解析によって立証した。
名古屋大学は2017年6月5日、小腸微小領域に内在するペースメーカー細胞群が、「腸の法則」に捉われない自由な自発性電位連携を創り出すことをイメージ解析によって立証したと発表した。同大学大学院 医学系研究科 研究補助員の岩田尚子氏と高井千穂氏、准教授の中山晋介氏のグループによるもので、成果は6月1日、医学雑誌「Gastroenterology」電子版に掲載された。
消化管が機能的運動をするためには、微小領域の協調が必要とされる。医学や生理学では「腸の法則」として、食物などによる消化管壁内部からの刺激により、口側の収縮と肛門側の弛緩がともに引き起こされるといわれている。また、腸に含まれる神経以外の多種類の興奮性細胞群も消化管の協調的活動に働いている可能性があり、ネットワーク状に分布するペースメーカー細胞群はその有力候補と考えられる。
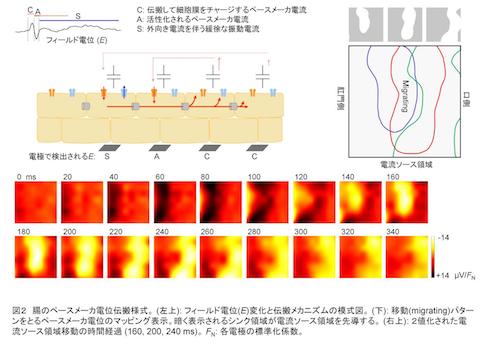
同研究では、透析膜補強微小電極アレイ(MEA)法を用いて、典型的ペースメーカー活動を示すマウス小腸筋層の自発性電位を記録し、微小領域の時間空間的連携活動をイメージ解析した。
その結果、ペースメーカー電位の連携活動は、大きく3つのパターンに分類できた。まず、bumpyパターンでは、電気的連結が乏しく同調性が減弱していることが示唆された。expandingパターンでは、小さな領域で発生した活動が周囲の微小領域に伝搬し、長時間活動を継続していた。migratingパターンでは、長方形様の活動部位が長軸とおよそ直交方向に進行していった。
さらに長時間観察したところ、ペースメーカー電位の連携活動に、サイクルごとに変動/ゆらぎがあった。例えば、expandingパターンを示す標本では、発生位置が顕著に移動するものがあった。migratingパターンを示す標本では、口側/肛門側が逆転するなど、いろいろな方向への電位活動の進行が観察された。いくつかのmigratingパターンを示す標本では、一過性の正電位領域に続き、ペースメーカー電流の細胞内流入(負電位)領域が進行していた。
同研究で確認された3つのパターンは、例えば、静止状態/すりつぶし/推進様の運動に対応すると推測され、今後の研究によって対応する機能の解明が期待される。また、この電位画像解析法は、自動技術などを組み込むことで、興奮性細胞標本の精密な機能分析法として、薬剤効果判定や疾患モデル動物研究などへ広く応用できる可能性があるとしている。
関連記事
 慢性炎症による大腸がん悪性化の仕組みを解明
慢性炎症による大腸がん悪性化の仕組みを解明
金沢大学は、慢性炎症による大腸がん悪性化の仕組みについて明らかにした。悪性化の過程に慢性炎症反応が関わっている可能性があり、今後、慢性炎症の制御によってがんの悪性化を制御できると期待される。 大腸がん幹細胞を標的とした治療モデルの開発に成功
大腸がん幹細胞を標的とした治療モデルの開発に成功
慶應義塾大学は、大腸がんの増殖をつかさどる「がん幹細胞」の詳細な機能の解析と、がん幹細胞を標的とした治療モデルの開発に成功した。がんの新たな根源的治療法の開発につながることが期待される。 CMOSセンサーを搭載した上部消化管用拡大スコープを発売
CMOSセンサーを搭載した上部消化管用拡大スコープを発売
富士フイルムは、レーザー光源内視鏡システム「LASEREO」用スコープとして、上部消化管用拡大スコープ「EG-L600ZW」を発売した。イメージセンサーに高解像度のCMOSセンサーを搭載し、低ノイズで高解像度な画像を提供する。 脂肪肝の発症メカニズムを解明
脂肪肝の発症メカニズムを解明
大阪大学は、肝臓でタンパク質Rubiconの発現が上昇し、オートファジー(細胞内の分解機構)を抑制することが、脂肪肝の原因であることを明らかにした。 試験管内で、マウスES細胞から胃の組織細胞の分化に成功
試験管内で、マウスES細胞から胃の組織細胞の分化に成功
産業技術総合研究所は、マウスES細胞から、試験管内で胃の組織を丸ごと分化させる培養技術を開発したと発表した。この胃組織は、胃粘液や消化酵素を分泌し、ヒスタミン刺激に応答して胃酸も分泌した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
コーナーリンク