蒸留および蒸留塔の基本原理:はじめての化学工学(14)(1/2 ページ)
化学プラントや製造現場で最も一般的な分離操作が蒸留です。今回は、蒸留の原理から、産業用途で用いられる蒸留塔の構造について解説します。
蒸留とは?
蒸留とは、混合液を蒸発と凝縮によって分離する技術です。例えば、水とアルコールのように、揮発性が異なる成分の混合物を分離するときに利用します。この混合物を加熱して沸騰させると、蒸気中には沸点の低い成分(低沸点成分)が多く含まれます。この蒸気を冷やして液体に戻す(凝縮する)ことで、元の液よりも純度の高い成分を取り出すことができます。
液体の表面から分子が飛び出す現象が「蒸発」、液体の内部からも激しく気化が始まる現象が「沸騰」です。沸騰は、液体の蒸気圧が周囲の圧力(外圧)と等しくなったときに起こります。そのときの温度が沸点です。
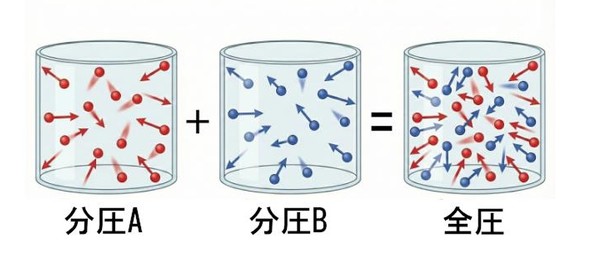
密閉容器内で蒸発と凝縮の速度が釣り合い、液量と蒸気量が一定に保たれている状態を気液平衡と呼びます。このとき、蒸気中の成分の割合(分圧)は、ラウールの法則およびドルトンの分圧の法則で説明されます。
- ラウールの法則:液中の各成分の分圧は、「その成分の純粋な蒸気圧×液中のモル分率」になる
- ドルトンの分圧の法則:蒸気全体の圧力(全圧)は、各成分の分圧の和になる
これらを組み合わせると、蒸気圧が高い(沸点が低い)成分ほど、気相側に多く配分されるということが分かります。
単蒸留から蒸留塔へ
実験室で行われるような、フラスコで1回だけ蒸留する操作が単蒸留です。しかし、沸点の差が小さい混合物の場合、1回の蒸留だけでは十分に分離できません。そこで、高純度な製品を得るために、凝縮物を再度蒸留します。目的の純度になるまで、再蒸留操作を繰り返します。
しかし、量産の規模になると、単蒸留設備の大量設置はスペースやコストの面から現実的ではありません。
そこで、蒸留塔(精留塔)が用いられます。蒸留塔は、単蒸留を何回も繰り返す効果を、1本の塔の中で連続的に得られる装置です。塔の中段あたりから原料を投入します。塔の頂上(塔頂)からは低沸点成分を多く含む蒸気が出ていき、これをコンデンサー(凝縮器)で冷やして液体にします。
一方、塔の底(塔底)には高沸点成分が集まります。一部は回収液として取り出しつつリボイラー(再沸器)で加熱して再び蒸気として塔内に戻します。塔内は、中段程度の原料を供給する位置を境に、上部(濃縮部)と下部(回収部)で役割が異なります。濃縮部は、上昇する蒸気中の低沸点成分をさらに濃縮し、塔頂から製品として取り出します。回収部は、下降する液から目的成分を蒸発させて回収し、塔底へ送る役割を担っています。
Copyright © ITmedia, Inc. All Rights Reserved.
素材/化学の記事ランキング
- 多孔質グラフェンを用いて全固体マグネシウム空気電池を開発
- 鉄鋼材料の強さを決める因子
- 遮熱機能を備えた熱マネジメント材料、熱暴走時に熱伝導率を10分の1以下に
- 不連続×連続繊維の熱可塑性ハイブリッド複合材、高い弾性率と賦形性を両立
- 三菱ケミカル、合成樹脂エマルジョン事業とアクリルエマルジョン事業を譲渡
- JX金属が茨城事業所で高純度CVD/ALD材料の量産ライン立ち上げ完了
- パナソニック エナジーがハイニッケル正極材を実現した策と次のターゲットとは?
- 信越化学が米国で塩ビ原料の生産力を増強、投資金額は5300億円
- 100℃前後の低温領域で使用可能なPd水素透過膜、水素センサー高精度化に貢献
- 油付きPETボトルの再生材料を食用油容器の一部に使用
コーナーリンク