蒸留および蒸留塔の基本原理:はじめての化学工学(14)(1/2 ページ)
化学プラントや製造現場で最も一般的な分離操作が蒸留です。今回は、蒸留の原理から、産業用途で用いられる蒸留塔の構造について解説します。
蒸留とは?
蒸留とは、混合液を蒸発と凝縮によって分離する技術です。例えば、水とアルコールのように、揮発性が異なる成分の混合物を分離するときに利用します。この混合物を加熱して沸騰させると、蒸気中には沸点の低い成分(低沸点成分)が多く含まれます。この蒸気を冷やして液体に戻す(凝縮する)ことで、元の液よりも純度の高い成分を取り出すことができます。
液体の表面から分子が飛び出す現象が「蒸発」、液体の内部からも激しく気化が始まる現象が「沸騰」です。沸騰は、液体の蒸気圧が周囲の圧力(外圧)と等しくなったときに起こります。そのときの温度が沸点です。
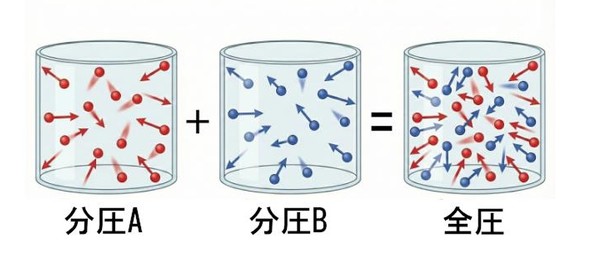
密閉容器内で蒸発と凝縮の速度が釣り合い、液量と蒸気量が一定に保たれている状態を気液平衡と呼びます。このとき、蒸気中の成分の割合(分圧)は、ラウールの法則およびドルトンの分圧の法則で説明されます。
- ラウールの法則:液中の各成分の分圧は、「その成分の純粋な蒸気圧×液中のモル分率」になる
- ドルトンの分圧の法則:蒸気全体の圧力(全圧)は、各成分の分圧の和になる
これらを組み合わせると、蒸気圧が高い(沸点が低い)成分ほど、気相側に多く配分されるということが分かります。
単蒸留から蒸留塔へ
実験室で行われるような、フラスコで1回だけ蒸留する操作が単蒸留です。しかし、沸点の差が小さい混合物の場合、1回の蒸留だけでは十分に分離できません。そこで、高純度な製品を得るために、凝縮物を再度蒸留します。目的の純度になるまで、再蒸留操作を繰り返します。
しかし、量産の規模になると、単蒸留設備の大量設置はスペースやコストの面から現実的ではありません。
そこで、蒸留塔(精留塔)が用いられます。蒸留塔は、単蒸留を何回も繰り返す効果を、1本の塔の中で連続的に得られる装置です。塔の中段あたりから原料を投入します。塔の頂上(塔頂)からは低沸点成分を多く含む蒸気が出ていき、これをコンデンサー(凝縮器)で冷やして液体にします。
一方、塔の底(塔底)には高沸点成分が集まります。一部は回収液として取り出しつつリボイラー(再沸器)で加熱して再び蒸気として塔内に戻します。塔内は、中段程度の原料を供給する位置を境に、上部(濃縮部)と下部(回収部)で役割が異なります。濃縮部は、上昇する蒸気中の低沸点成分をさらに濃縮し、塔頂から製品として取り出します。回収部は、下降する液から目的成分を蒸発させて回収し、塔底へ送る役割を担っています。
Copyright © ITmedia, Inc. All Rights Reserved.
素材/化学の記事ランキング
- トヨタのEVに載る全固体電池向け固体電解質の大型製造装置を建設
- レアメタルを使わないシリコーン硬化用の鉄触媒を開発
- 富士フイルムが営業利益で過去最高、「半導体材料」と「チェキ」好調
- エンプラが半導体製造装置用途で堅調も三菱ケミカルGは減収減益、要因とは
- 厚さ200μmで柔らかくのりのはみ出しが少ないバックグラインドシート
- 10万原子のシミュレーションを1週間で、富士通MI技術の「異次元の高速化」
- ペロブスカイト太陽電池の高効率化と高耐久化を実現する添加剤を発売
- エネルギー消費量を最大75%削減する平膜型排水処理技術の確立にめど
- 車載向け全固体電池に絶妙な圧力で、固体電解質と電極をつなぐ緩衝材
- 商業スケールでPMMAケミカルリサイクル技術のライセンス提供開始
コーナーリンク