医療機器のサイバーセキュリティリスクを“診断”、テストサービス提供開始:製造ITニュース(2/2 ページ)
非輸出の医療機器もガイダンスの対象になり得る
貝田氏は、米国と欧州、日本の3地域における医療機器のセキュリティリスクに対する法規制の現状についても解説した。
同氏によると、3地域の中で法規制に関連した取り組みが最も進んでいるのは米国だという。医療機器の監督機関である食品医薬品局(FDA)は以前からサイバーセキュリティガイダンスを一般公開し、パブリックコメントを取り入れてその内容を洗練してきた。また、医療機器の市販前認可方式である「FDA 510K」の申請時にはサイバーセキュリティ関連文書の提出を要求する。文書内に記載されたセキュリティ対応が十分ではないと見なされた場合は、追加文書の提出が必要となり、最悪、認可を却下されるケースもあるという。
また、患者の医療情報保護に関する法律である「HIPAA(Health Insurance Portability and Accountability Act)」は、個人情報の保護に関して厳しい規定を定めている。機器納入時には、機器に施したサイバーセキュリティ対策に関して医療機器メーカー側に説明が求められることもある。
欧州は「EU一般データ保護規則(GDPR:General Data Protection Regulation)」に代表されるように、3地域の中で個人情報保護に関する意識が最も高いという特徴がある。医療機器のサイバーセキュリティ対策に対しても高い関心を払っており、医療機器調整グループ(MDCG:Medical Device Coordination Group)が違反者への罰金を伴うセキュリティガイダンスを出している。
そして日本では、医療業界に関与する世界各国の監督機関が集う国際医療機器規制当局フォーラム(IMDRF:International Medical Device Regulators Forum)が作成したガイダンスを、早ければ2022年にも国内で適用開始すると厚生労働省が発表した。ガイダンス中にはサイバーセキュリティのリスクマネジメント対策が盛り込まれる予定である。国内販売される医療機器にも適用される可能性があるため「輸出を前提とした医療機器だけでなく、国内流通の予定がある医療機器も必要になる」(貝田氏)という。
これらのセキュリティを巡る法規制の動向を踏まえて、貝田氏はテストサービスの必要性について、「人間が健康診断を通じて身体異常の早期発見を行うのと同様に、機器に潜むリスクを理解することは重要だ。リスクを抑えるためにソフトウェア/ハードウェアに修正を加えなければならないケースもある。まずは問題を正確に把握して、必要な対策をピンポイントで講じるべきだ。ただ対策の必要性が分かっていても何から手を付ければよいか分からないというメーカーも多いだろう。その場合はテストサービスを利用してほしい」と指摘した。
関連記事
- ≫連載記事「製造業が直面するサイバーリスクと対策」バックナンバー
 インダストリー4.0に見る日独における生産技術のさらなる進化 ――独NRW州セミナー
インダストリー4.0に見る日独における生産技術のさらなる進化 ――独NRW州セミナー
ドイツのノルトライン・ヴェストファーレン(NRW)州経済振興公社とテュフ ラインランド ジャパンは「日独が描く未来工場・生産技術」をテーマに2014年9月26日にセミナーを開催し、インダストリー4.0をはじめとした生産技術のさまざまな現状と進化について紹介した。本稿では、そのうち欧州Kawasaki Robotics社長の高木登氏、テュフ ラインランド ジャパン 産業サービス部 部長代理 杉田吉広氏の講演内容を紹介する。 クルマの板金塗装にも認証制度、修理の品質保証へ取得企業増加
クルマの板金塗装にも認証制度、修理の品質保証へ取得企業増加
中古車販売大手のビッグモーターとテュフ ラインランド ジャパンは2019年6月26日、東京都内で記者会見を開き、ビッグモーターの全国29カ所の板金塗装工場でテュフ ラインランドの板金塗装工場認証(以下BP認証)を取得したと発表した。同認証は板金修理の品質を確認する体制が工場内に整っていることを認める制度。品質が保たれた修理が全国で行えることを強みに、板金塗装事業の売り上げを現状の3倍の300億円に増やす目標だ。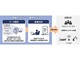 IoT製品に関連するセキュリティ情報を効率的に収集分析するサービス
IoT製品に関連するセキュリティ情報を効率的に収集分析するサービス
日立製作所は、さまざまな情報源から、自社IoT製品などのセキュリティ上の脅威に関わる情報のみを収集して分析する「脅威インテリジェンス提供サービス」を発売する。 デジタルで“品質”を再定義、細分化し複雑化する製品開発に対応せよ
デジタルで“品質”を再定義、細分化し複雑化する製品開発に対応せよ
Eコマースの発展などで顧客の要求が細分化し製品開発がより複雑になったことで、製造業の品質問題が頻発している。これまで品質管理を支えてきた熟練技術者の退職も進む中で、品質問題を解決するにはデジタル技術の導入が不可欠だ。PwCコンサルティングの「Quality Digital Transformation」は、先進のデジタル技術により、製造業の品質問題の発見や早期対応を強力に支援する。 産業用IoTゲートウェイが工場セキュリティの穴に、トレンドマイクロが警鐘
産業用IoTゲートウェイが工場セキュリティの穴に、トレンドマイクロが警鐘
セキュリティベンダーのトレンドマイクロは2020年10月13日、スマート化された産業制御システムのサイバーセキュリティリスクを明らかにするために行った実証実験の結果について、メディア向けオンラインセミナーで発表。産業用IoTゲートウェイがセキュリティ対策の盲点となっている状況があることを紹介した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
コーナーリンク






