欧州の医療機器規制改革とサイバーセキュリティ動向:海外医療技術トレンド(50)(2/3 ページ)
フランス規制当局が医療機器サイバーセキュリティガイドライン草案を公表
先述の本連載第33回では、欧州NIS指令についても取り上げているが、各国の医療機器規制当局でも、サイバーセキュリティのハーモナイゼーションに向けた動きが本格化している。
2019年7月19日、フランス医薬品・保健製品安全庁(ANSM)は、「ライフサイクルにおいてソフトウェアと統合される医療機器のサイバーセキュリティ」ガイドライン草案を公表した(関連情報)。このガイドライン草案は、医療機器(MD)(単体もしくはコンビネーションで人間向けに使用される器具、装置、アプライアンス、ソフトウェア、インプラント、試薬、材料またはその他の物品など)および体外診断用医療機器(IVDMD)(単体もしくはコンビネーションでイン・ビトロ向けに使用される試薬、試薬製品、キャリブレーター、制御材料、キット、器具、装置、機器部品、ソフトウェア/システムなど)の双方を対象としている。
ANSMは、サイバーセキュリティについて、「医療機器の完全性(Integrity)や可用性(Availability)、対象となる攻撃のリスクに対して医療機器が保持する情報またはアウトプットの機密性を保証するために設定された、一連の技術的または組織的対策」であるとしている。図1は、ガイドライン草案が対象とするサイバーセキュリティの主要な基準を示している。
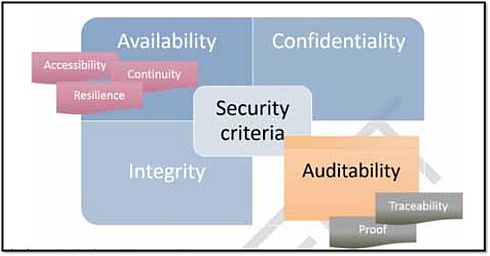 図1 サイバーセキュリティの主要な基準(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)
図1 サイバーセキュリティの主要な基準(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)ANSMガイドライン草案の特徴は、完全性、可用性、機密性に加えて、可監査性(Auditability)を掲げている点にある。可監査性とは、保護対象資産上で実行された業務の記録を保存し、モニタリングまたは調査目的のためにこれらの記録の操作性を保証するシステム能力のことであり、トレーサビリティー、証跡などが含まれる。
フランスでは、国家サイバーセキュリティ庁(ANSSI)(関連情報)が、国全体レベルの情報システムセキュリティ(ISS)を所管しており、医療分野でも、ANSSIのガイドライン類やベストプラクティス集をリソースとして活用している。図2は、ガイドライン草案の中で、情報システムセキュリティ(ISS)に関するリスク管理の主要原則を示したものであり、以下のような項目が含まれる。
- 予防:多層防御の概念
- インストールのモニタリングとインシデント検知
- インシデント処理、アラート、対応の連鎖
- 脅威と脆弱性のモニタリング
- 災害復旧計画(DRP)と事業継続計画(BCP)
- スタッフの認識向上
- インストールの作図とリスク分析
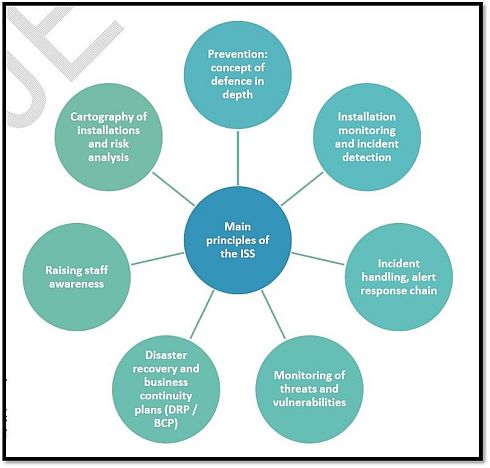 図2 情報システムセキュリティ(ISS)の主要原則(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)
図2 情報システムセキュリティ(ISS)の主要原則(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)リスク分析手法についても、ANSSIが開発したEBIOS(Expression des Besoins et Identification des Objectifs de Sécurité)を採用している。この分析モデルは、「コンテキストの検証」「有害事象の検証」「脅威シナリオの検証」「リスク評価」「セキュリティ要求事項の特定」から構成される。
ガイドライン草案は、EBIOSを医療機器ライフサイクルのリスク管理に適用した上で、図3に示す通り、セーフティとセキュリティ双方の観点から、情報システムセキュリティ(ISS)とISO 14971(医療機器 - リスクマネジメントの医療機器への適用)を組み合わせたアプローチを採っている。
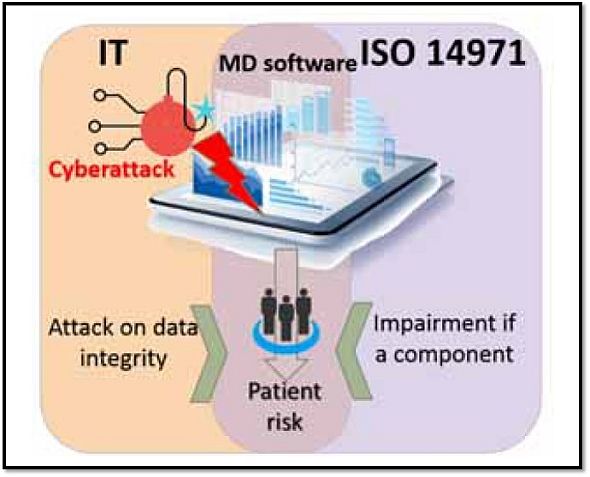 図3 医療機器情報システム(MDIS)向けの情報システムセキュリティ(ISS)とISO 14971の連携 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)
図3 医療機器情報システム(MDIS)向けの情報システムセキュリティ(ISS)とISO 14971の連携 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)セーフティについては、医療機器が正確に作動することを保証し、ランダムな意図しないリスクを予防して、ユーザーエラーを取り囲むものとしている。他方、セキュリティについては、医療機器の作動を妨げる可能性がある外部からの攻撃に対して、医療機器が保護されることを保証するものとしている。
そして、図4は、医療機器ライフサイクルの各ステージからみたリスク分析のフローを示しており、課題点として、設計前の基礎的なリスク分析、開発後のリスク分析再評価、使用前のリスク分析モニタリング、生産後の維持/更新/モニタリングを掲げている。
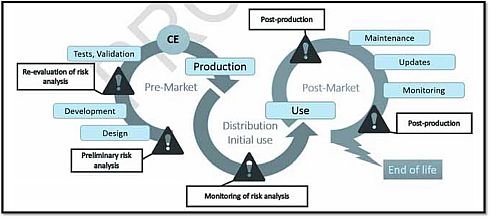 図4 医療機器ライフサイクルにおけるリスク分析(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)
図4 医療機器ライフサイクルにおけるリスク分析(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)ガイドライン草案では、この医療機器ライフサイクルの各ステージに対応する形で、表1のような推奨事項を提示している。
 表1 フランスANSM医療機器サイバーセキュリティガイドライン草案の推奨事項(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)を基にヘルスケアクラウド研究会作成
表1 フランスANSM医療機器サイバーセキュリティガイドライン草案の推奨事項(クリックで拡大) 出典:Agence Nationale de Securite du Medicament et des Produits de Sante (ANSM)「Cybersecurity of medical devices integrating software during their life cycle」(2019年7月19日)を基にヘルスケアクラウド研究会作成ANSMは、前回取り上げたオーストラリア薬品・医薬品行政局(TGA)と同様に、市販前対策と市販後対策を包括的にカバーするライフサイクル管理アプローチの観点から、医療機器サイバーセキュリティガイドラインの要求事項を整理している。今後、他のEU加盟国の規制当局が、域内の医療機器規制ルール統一化に向けて、どのようなガイドライン草案を策定するのかが注目される。
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
- なぜPM2.5で花粉症がひどくなる? スズと粘液の反応によるメカニズムを発見
コーナーリンク



