がん免疫療法が効かなくなるメカニズムを解明:医療技術ニュース
慶應義塾大学は、転移性尿路上皮がんの免疫チェックポイント阻害薬耐性の仕組みを解明した。がん細胞に繰り返し生じる遺伝子変異が多種の悪性サブクローンを生み、治療で克服しにくい免疫抑制環境を形成することが分かった。
慶應義塾大学、東京大学、東京科学大学は9月1日、転移性尿路上皮がんの免疫チェックポイント阻害薬耐性の仕組みを解明したと発表した。がん細胞に繰り返し生じる遺伝子変異が多種の悪性サブクローンを生み、治療で克服しにくい免疫抑制環境を形成することが分かった。
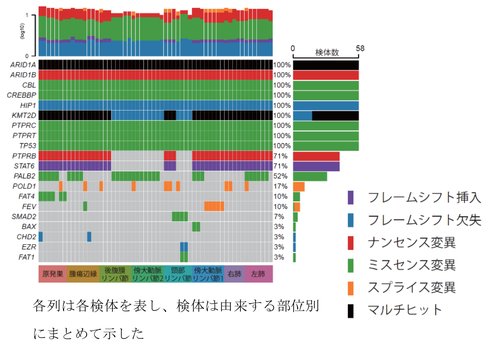
研究では、転移性尿路上皮がんの病理解剖例において、抗PD-1療法の反応が異なる8部位を対象に全ゲノムシーケンスを実施。同一患者内で、各部位の腫瘍に異なるパターンの遺伝子変異が見られた。
この8部位に計58箇所の評価点を設定し、多領域全エクソームおよびRNAシーケンスを実施した。その結果、多くの変異は部位間で共通したが、一部は同一臓器内でも異なり、部位ごとの特異的変異や生物学的経路の活性化などが示唆された。これらのことから、同じ臓器内でも異なる場所で違った表現型が誘導されることが分かった。
腫瘍空間に存在するクローン集団を推測できるパイクローンによる解析では、19のサブクローンを同定した。うち#12と#14が、効果が見られなかった部位に多く存在し、悪性クローンと判断した。
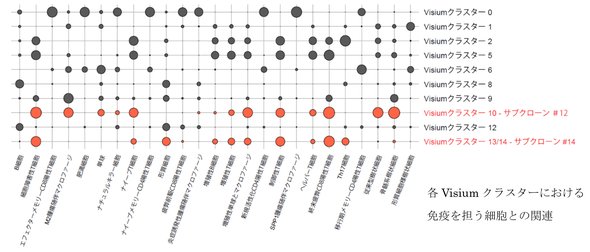
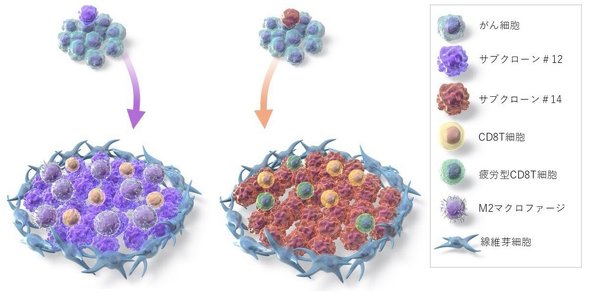
この2つのサブクローンを空間トランスクリプトミクスと単一細胞解析でマッピングしたところ、#12の領域では細胞障害性T細胞に加え、悪性なM2マクロファージの浸潤が確認された。#14の領域では細胞障害性T細胞の疲弊が特徴的で、免疫抑制が制御されていない状態が示唆された。
遺伝子発現解析では、#12はがん幹細胞性、#14は細胞増殖能亢進が特徴だった。これらの結果から、#12と#14は単一細胞レベルでも異なるがんプロファイルを持ちつつ同一患者内で共存し、固有の免疫抑制環境を形成していることが明らかとなった。
近年、一部の悪性度が高いサブクローンが、腫瘍全体の挙動に影響を与えるという「悪いリンゴ(bad apple)」概念が注目されている。今回得られた知見により、サブクローン標的化や免疫微小環境の改変など、新たな免疫治療への展開が期待される。
関連記事
 欧州が運用を開始するAI法は医療分野と調和できるか、量子技術との融合にも注目
欧州が運用を開始するAI法は医療分野と調和できるか、量子技術との融合にも注目
本連載第116回で欧州保健データスペース(EHDS)を取り上げたが、2025年8月2日に汎用目的人工知能(GPAI)に関わるAI法のルールが適用開始となった欧州では、量子技術との融合に向けたアクションが本格化している。 生きたまま動物の頭蓋骨を透明化する技術を開発
生きたまま動物の頭蓋骨を透明化する技術を開発
新潟大学は、生きている動物の頭蓋骨を観察時だけ高度に透明化し、脳内を非侵襲、高精度にライブ観察できる頭蓋骨透明化技術「シースルー法」を開発した。 人の状態をカメラレスで検知する、ミリ波レーダーモジュールと評価キット
人の状態をカメラレスで検知する、ミリ波レーダーモジュールと評価キット
旭化成エレクトロニクスは、アンテナ一体型ミリ波レーダーモジュール「AiM」と小型評価キットを組み合わせたセンシングソリューションの提供を開始した。カメラを使わずに、見守りなど人の状態検知を実装できる。 神経回路の発達はシナプス伝達が不要/要の二段階で進行する
神経回路の発達はシナプス伝達が不要/要の二段階で進行する
帝京大学と東京大学は、小脳のプルキンエ細胞にシナプス入力する登上線維の「勝ち残り」過程について、シナプス伝達非依存的な選抜とシナプス伝達依存的な精緻化の二段階で進むことを明らかにした。 海外依存脱却へ、国産の生体電極フィルムとペーストを発表
海外依存脱却へ、国産の生体電極フィルムとペーストを発表
ペルノックスは、生体電極業界の海外依存を断ち、供給の安定化を狙う、国産の生体電極用フィルム「SilkyLink MFX-1100」と生体電極用ペースト「Pertron K-398X」シリーズを発表した。 UV-C LEDの効率を2倍に向上、水銀不使用の殺菌へ
UV-C LEDの効率を2倍に向上、水銀不使用の殺菌へ
ams OSRAMは、殺菌用途向けのUV-C LEDで、従来比約2倍となる電力変換効率10.2%を達成した。波長265nm、200mW出力クラスの評価デバイスで検証し、ドイツの国立計測機関PTBが10.2%のWPEを実証した。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- おむつかぶれや尿路感染を防ぐ、体外式カテーテルに新製品
- 3DとAIで数十万の細胞を解析する「自律型デジタル細胞診」システムを開発
- 減らすだけでは効果なし、完全禁酒/禁煙で食道がん治療後の発生リスクが5分の1に
- 「入れ歯」専用の次世代3Dプリンタ、2027年市場投入へ
- 既存薬が効きにくいがんにも光、BNCT用ホウ素薬剤を開発
- 自宅での「尿検査」がより正確に、小型二電極バイオセンサーを開発
- 対象所見を10種類に拡充した胸部単純X線画像病変検出ソフトの提供を開始
- 体温の日内制御、恒温動物と変温動物で共通の仕組みを発見
- 不公平な提案を受諾する際の脳内抑制メカニズムを解明
- 新型コロナ向け「ワクチン接種パッチ」の実用化へ前進、自己接種も可能に
コーナーリンク