細菌やウイルスへの感染を防ぐ酵素の制御機構を解明、新規治療ターゲットに:医療技術ニュース(1/2 ページ)
京都大学は2020年5月15日、免疫応答や細胞死制御に加え、感染防御に重要な役割を果たす複合体ユビキチンリガーゼ(LUBAC)の新規活性制御機構を明らかにしたと発表した。
京都大学は2020年5月15日、免疫応答や細胞死制御に加え、感染防御に重要な役割を果たす複合体ユビキチンリガーゼ(LUBAC)の新規活性制御機構を明らかにしたと発表した。研究成果は感染症や免疫不全症の治療につながる可能性もあると期待されている。
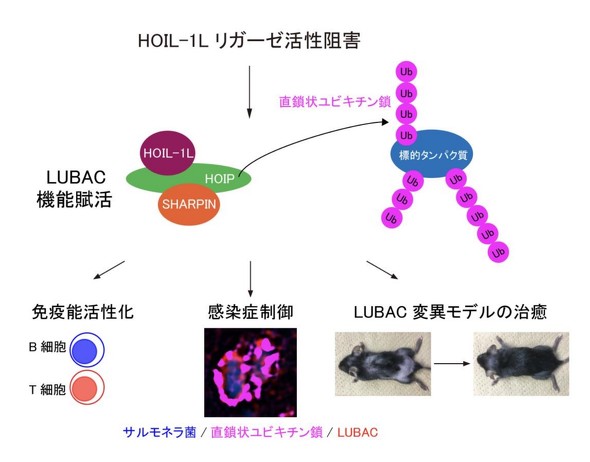
LUBACは赤痢菌やレジオネラ菌などの細菌感染症やウイルス感染症制御に関わることが報告されおり、LUBACの機能低下は免疫不全の原因となる。LUBACは活性中心を有するHOIPと、アクセサリー分子であるHOIL-1L、SHARPINの3つによって安定して存在する。今回の研究では、HOIL-1Lのユビキチンリガーゼ(E3)酵素活性がLUBACの直鎖状ユビキチン鎖生成能を抑制しており、HOIL-1LのE3活性を阻害すれば、LUBACの機能を増強できることを発見した。
HOIL-1LのE3酵素活性阻害によってサルモネラ菌感染の抑制や、LUBAC機能不全による自己炎症性皮膚炎を治癒できることが明らかになっており、HOIL-1Lの酵素活性阻害は感染症の治療や免疫不全患者の治療につながる可能性がある。研究チームではHOIL-1LのE3酵素活性阻害剤の開発に着手しているという。
LUBACの活性亢進がインフルエンザウイルスの感染を抑制することも示唆されているため、同じRNAウイルスである新型コロナウイルス(SARS-CoV2)感染にもHOIL-1LのE3酵素活性阻害剤が効果を発揮する可能性もある。
E3酵素であるLUBACは、直鎖状ユビキチン鎖を特異的に生成することで、刺激依存的なNF-κB(※)の活性化亢進、プログラム細胞死の抑制に対して中核的な機能を果たしており、それらを介して赤痢菌やレジオネラ菌などの細菌感染やウイルス感染を抑制する。
(※)NF-κBは免疫応答に重要な役割を果たす転写因子で、LUBACの機能低下は免疫不全を伴う自己炎症性症候群を発症する。
研究チームが、HOIL-1LのE3酵素活性の機能解明を進めるために、E3活性を消失したHOIL-1L変異体を細胞に導入したところ、LUBACの活性中心であるHOIPによって生成される直鎖状ユビキチン鎖が著しく増えて、細胞死抑制とNF-κB活性化機能が顕著に亢進した。このためHOIL-1Lの酵素活性はLUBACの機能を抑制すると考えられた。そこで、その分子メカニズムの解明を進めたところ、HOIL-1LがLUBACのすべてのサブユニットにユビキチンを1つ付け、HOIPがHOIL-1Lによって結合されたユビキチンを認識して、LUBAC上に直鎖状ユビキチン鎖を形成することが分かった。
LUBACのサブユニットが直鎖状ユビキチン化されればLUBACの機能が低下することは知られていたため、HOIL-1LのE3酵素活性は、HOIPがLUBACを直鎖状ユビキチン化する「きっかけ」を作ることでLUBACの直鎖状ユビキチン鎖生成を抑制することを明らかにした。したがって、HOIL-1Lの酵素活性が消失すれば、LUBACが直鎖状ユビキチン化されなくなるので、LUBACの機能が活性化される。
Copyright © ITmedia, Inc. All Rights Reserved.
医療機器の記事ランキング
- 赤色レーザーダイオードで光合成速度が最大2割向上、植物工場での活用へ
- 先天性の「足の臭い」、長島型掌蹠角化症の原因菌と有効治療法を発表
- 心不全患者向けアプリ、在宅で食事やセルフケアも支援
- 健康な社会づくりを目指すミラノ・コルティナ2026とイタリアのAI/サイバー政策
- 卵の段階でひよこの性別を選別する画像認識AIを開発
- 15種類の肌悩みを解析するAI技術を肌測定アプリに提供
- 画像データで測定できる小型尿分析器を開発、設置面積は約3分の2
- 医薬品の安定供給へ、東和薬品と大塚製薬が戦略的協業を開始
- コンタクトをつけるだけで眼圧を測定、緑内障の早期発見へ
- オリンパスが八王子に本社を移転、全ての事業機能を集約したグローバル本社へ
コーナーリンク