血管内皮細胞はオートファジーが苦手? 侵入してきた細菌を識別する仕組みを解明:医療技術ニュース
大阪大学は、血管の内皮細胞ではオートファジーによる細菌の除去ができず、細胞内で細菌が増殖することを発見した。一方で、潜在的には、細菌を除去する能力があることも分かった。
大阪大学は2017年7月7日、血管の内皮細胞ではオートファジーによる細菌の除去ができず、細胞内で細菌が増殖することを発見したと発表した。一方で、血管内皮細胞には、オートファジーによって細菌を除去するための潜在的能力があることも明らかにした。大阪大学大学院 生命機能研究科/医学系研究科 教授の吉森保氏らの研究グループによるもので、成果は同日、米科学誌「PLOS Pathogens」電子版に公開された。
オートファジーは、自らの細胞内の構成成分を分解する仕組みのことで、2016年に東京工業大学 栄誉教授の大隅良典氏がノーベル医学生理学賞を受賞し、注目を集めている。
元来、オートファジーは、栄養不足時にエネルギーなどを確保する経路として知られている。近年では、損傷を受けたミトコンドリアなどの有害因子を分解し、細胞を助けていることが明らかになってきた。皮膚などの上皮細胞では、オートファジーによって細菌を食べて殺していること(ゼノファジー)が判明しているが、上皮細胞以外のゼノファジーについては分かっていなかった。
今回、研究グループは細菌が血管内に入り込んで感染症が重篤化した際に、細菌の感染のターゲットとなる血管内皮細胞でのオートファジーに着目した。
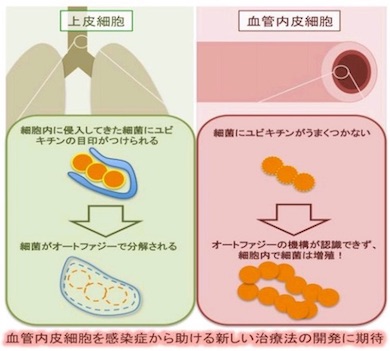
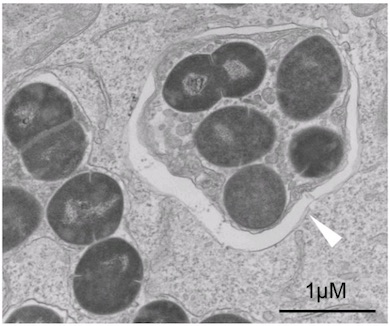
実験ではまず、A群レンサ球菌などの細菌をヒト培養細胞に感染させた。これらは上皮細胞内では増殖しないが、血管内皮細胞では増殖が止まらず細胞死を引き起こした。侵入した細菌を電子顕微鏡で撮影すると、血管内皮細胞ではオートファジーによる細菌の除去ができず、それによって細胞内で細菌が増殖することが分かった。
また、血管内皮細胞では、ユビキチンというタンパク質が細菌にうまく付かず、オートファジーの機構が細菌を認識できていなかった。通常ユビキチンは、細胞内に侵入した細菌に付き、オートファジーの食べる目印になる。そのため、細菌をユビキチンでコーティングしてから血管内皮細胞に感染させたところ、細菌はオートファジーによって除去された。このことから、細菌の除去は細菌を識別するシステムの問題であり、潜在的には細菌を分解する能力が備わっていることが分かった。
この成果から、血管内皮細胞のオートファジーが感染症治療のターゲットとなり得ることが明らかになった。今後は、なぜ血管内皮細胞内では侵入した細菌にユビキチンが付けられないのかを解明、また、血管内皮細胞で細菌に特異的なオートファジーを誘導する方法を見出すことで、感染症の新しい治療法の開発につながることが期待される。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 脂肪肝の発症メカニズムを解明
脂肪肝の発症メカニズムを解明
大阪大学は、肝臓でタンパク質Rubiconの発現が上昇し、オートファジー(細胞内の分解機構)を抑制することが、脂肪肝の原因であることを明らかにした。 パーキンソン病の発症に関わる遺伝子変異メダカの作製に成功
パーキンソン病の発症に関わる遺伝子変異メダカの作製に成功
京都大学は、パーキンソン病の発症に関わる遺伝子変異メダカを作製・解析することで、パーキンソン病の発症メカニズムの一端を解明した。GBA遺伝子の変異がパーキンソン病発症の最も強い危険因子であることから、GBA欠失メダカを作製した。 熱帯感染症診断に適した遺伝子検査システムの共同研究を開始
熱帯感染症診断に適した遺伝子検査システムの共同研究を開始
長崎大学は、熱帯感染症や新興・再興感染症を対象にした新たな遺伝子検査システムの開発について、東芝メディカルシステムズと共同研究契約を締結した。2016年8月から2年間、共同研究に取り組む。 結核菌を感知するセンサー分子を発見
結核菌を感知するセンサー分子を発見
九州大学は、結核菌を感知するセンサー分子を発見した。この研究成果は、体が結核菌を認識し、排除する仕組みを解明したもので、次世代の結核ワクチン開発に加え、感染症やがんを治療する薬剤開発への応用が期待される。 インフルエンザも未病状態で検知! 実世界のカオス現象と数理モデル化
インフルエンザも未病状態で検知! 実世界のカオス現象と数理モデル化
複雑系数理モデルを解析することによって、病気や電力ネットワークの不安定化、交通渋滞などの予兆を捉えられるようになるという。