B型肝炎ウイルスがサルに感染しない理由を解明:医療技術ニュース
東京理科大学は、カニクイザルとヒトの胆汁酸輸送体(NTCP)の立体構造を解析し、B型肝炎ウイルス(HBV)の感染を左右するNCTPの構造的特徴を明らかにした。NTCP分子内の2つのアミノ酸が、HBV受容体として機能するかどうかを決定する。
東京理科大学は2024年12月3日、カニクイザルとヒトの胆汁酸輸送体(NTCP)の立体構造を解析し、B型肝炎ウイルス(HBV)の感染を左右するNCTPの構造的特徴を明らかにしたと発表した。横浜市立大学、京都大学、国立感染症との共同研究による成果だ。
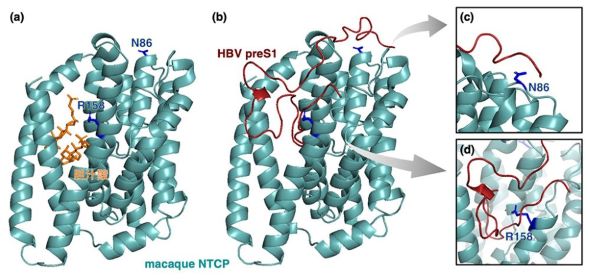
HBVは、ヒトやチンパンジーには感染するが、アカゲザルやカニクイザルなどのサルには全く感染しない。今回の研究では、96.0%と高いアミノ酸相同性を示す、カニクイザルNTCP(mNTCP)とヒトNTCP(hNTCP)の構造を比較した。
クライオ電子顕微鏡構造や遺伝子変異導入、ウイルス感染、胆汁酸輸送、分子動力学シミュレーションなどを用いて解析したところ、preS1との結合で、NTCP分子内の主に2カ所がHBV受容体として機能するかどうかを決定していることが分かった。preS1は、HBVの表面タンパク質内にある領域のことで、宿主動物の肝細胞に存在するNTCPと結合することで細胞内に侵入してHBVに感染する。
決定を左右する部位の1つ目は、NTCPの胆汁酸トンネル入口に位置する158番目のアミノ酸だ。hNTCPは側鎖のないグリシンのためpreS1がぴったりはまるが、mNTCPは大きな側鎖のあるアルギニンで入口が狭いため、preS1との結合が妨害される。
2つ目は、NTCPの細胞外表面に位置する86番目のアミノ酸となる。hNTCPでは、長い側鎖のあるリシンがpreS1をNTCP細胞外表面に強固につなぎとめて結合を安定させる。mNTCPでは、側鎖が比較的短いアスパラギンのため、preS1の動的なゆらぎを抑える力が弱く、結合が不安定になる。
またhNTCPは、内因性基質の長鎖胆汁酸が存在すると、立体障害が生じてPreS1結合が妨げられることも分かった。
今回の研究は、ヒトと進化的近縁種のサルがなぜHBVに感染しないかの本質を明らかにしたもので、HBV感染メカニズムの解明につながることが期待される。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 第2次トランプ政権で米国の医療IoT/OTセキュリティ規制はどうなるのか
第2次トランプ政権で米国の医療IoT/OTセキュリティ規制はどうなるのか
米国会計検査院(GAO)は、IoTやOTのサイバーセキュリティに関する報告書および勧告を通じて、保健福祉省や食品医薬品局による取り組みの改善状況をチェックしている。2025年から第2次トランプ政権が始まるが、GAOの勧告も併せて米国の医療IoT/OTセキュリティ規制の動向に注目が集まる。 着床不全のメカニズムをマウスを用いて解明
着床不全のメカニズムをマウスを用いて解明
東京大学は、マウスの着床モデルを用いて、着床不全が起こる仕組みの1つを明らかにした。子宮内膜の上皮と間質のそれぞれのサイトカイン「Leukemia inhibitory factor」が協働して胚接着と胚生育を調節し、着床が成立する。 アルカリ度が高い水は緑茶やコーヒーの香りを強くする
アルカリ度が高い水は緑茶やコーヒーの香りを強くする
LIXILは、水道水中のアルカリ度が緑茶やコーヒーなどの香りと味に及ぼす影響を調査し、アルカリ度が高いと香りが強くなることを確認した。味に関してもアルカリ度が高いと、うま味成分が増加する傾向となった。 血圧を測るだけで心房細動の可能性を検出するアルゴリズムを開発
血圧を測るだけで心房細動の可能性を検出するアルゴリズムを開発
オムロン ヘルスケアは、血圧を測定するだけで心房細動の可能性を検出する血圧計搭載アルゴリズム「Intellisense AFib」を開発した。米国食品薬品局のDeNovo認可を取得している。 高性能かつ環境に配慮した5Mピクセル対応の医用カラーモニターを発売
高性能かつ環境に配慮した5Mピクセル対応の医用カラーモニターを発売
EIZOは、輝度やコントラスト比が向上した、5Mピクセル対応の21.3型医用画像表示カラーモニター「RadiForce RX570」を発売する。輝度は1200cd/m2、コントラス比は2000:1に向上した。 日本アビオニクスが医用サーモグラフィーに再参入、国内唯一のポータブル型で
日本アビオニクスが医用サーモグラフィーに再参入、国内唯一のポータブル型で
日本アビオニクスは、患者の患部の温度分布を瞬時に可視化するポータブル型医用サーモグラフィー「F50ME」を開発した。バッテリーで駆動するポータブル型の医用サーモグラフィーとしては「国内唯一」(同社)とする。