細胞分裂をけん引する分子モーターが逆走する仕組みを解明:医療技術ニュース
理化学研究所は、細胞分裂をけん引する分子モーター「Kinesin-14」が、他のキネシンとは逆向きに動く分子メカニズムを解明した。
理化学研究所は2016年7月22日、細胞分裂をけん引する分子モーター「Kinesin-14(キネシン-14)」が、他のキネシンとは逆向きに動く分子メカニズムを解明したと発表した。同研究所ライフサイエンス技術基盤研究センターの仁田亮上級研究員と東京大学大学院総合文化研究科の矢島潤一郎准教授らの共同研究グループによるもので、成果は米科学誌「Structure」オンライン版に同月21日付で掲載された。
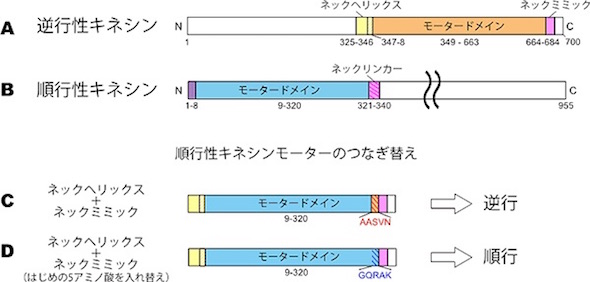
生物が作るタンパク質には、エネルギーを使って動く「分子モーター」がある。その1種であるキネシンは、ほ乳類では45種類あるとされ、細胞内の運び屋として重要な役割を担っている。ほとんどのキネシンは、微小管というレールの上をプラス端側へ動く順行性モーターだが、キネシン-14はマイナス端側へ動く逆行性モーターとして知られ、これまでその分子メカニズムは不明だった。
研究グループでは、まず、モータードメイン(領域)と呼ばれる動力部位に着目。逆行性キネシンには、モータードメインのアミノ末端側に「ネックへリックス」、カルボキシ末端側に「ネックミミック」と呼ばれるドメインがある。この2つのドメインを順行性キネシンのモータードメインにつなぐと、順行性キネシンが逆向きに動くことが分かった。また、逆行性になったキネシンのネックミミックの5個のアミノ酸を順行性キネシンのネックリンカーのものと入れ替えると、モーターの動く向きが逆転し、順行性になることが明らかになった。
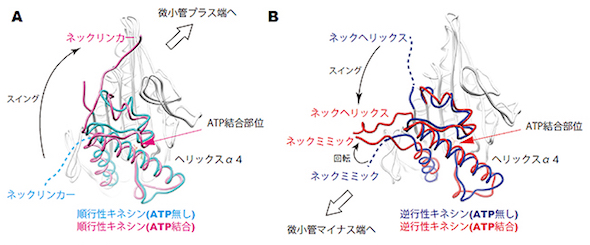
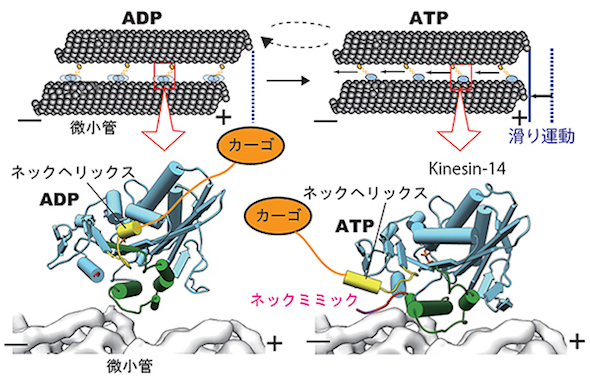
次に、キネシン-14の立体構造を解析し、分子メカニズムを調査した。その結果、順行性/逆行性どちらのモータードメインでも、アデノシン三リン酸(ATP)結合部位の周囲で小さな構造変化が起き、その構造変化が隣の長いらせん構造(ヘリックスα4)の回転運動を引き起こした。ネックミミックは、この構造変化を入力信号として受け、逆行性キネシンだけにあるネックヘリックスのスイングへと変換する役割を果たすことが分かった。さらに、そのスイングの向きが逆行性モーターの動く向きを決めており、細胞分裂の際に、逆行性キネシンが紡錘体の形成・染色体の整列に貢献するという機能を支えていることが判明した。
同成果は、細胞分裂における染色体分配の分子メカニズムの解明に寄与するだけでなく、細胞分裂を制御する分子モーターに対する新たな抗がん剤設計への応用など、さまざまな展開が期待できるとしている。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 マウスの「父性の目覚め」に関わる2つの脳部位を発見
マウスの「父性の目覚め」に関わる2つの脳部位を発見
理化学研究所は、雄マウスの子育て(養育行動)意欲が、「cMPOA」と「BSTrh」という2つの脳部位の活性化状態から推定できることを発見した。 京やFOCUSも社内ネットワーク感覚で利用可能なサービスを開始
京やFOCUSも社内ネットワーク感覚で利用可能なサービスを開始
CAEツールの提供・サポートを行うヴァイナスは、2015年春からクラウドHPCにおける自社開発ソルバーおよびオープンソルバ利用のサポートを本格的に開始する。 「やる気や頑張り」がリハビリの効果に影響することを証明
「やる気や頑張り」がリハビリの効果に影響することを証明
自然科学研究機構生理学研究所は、脊髄損傷後のサルの運動機能回復において、やる気や頑張りをつかさどる「側坐核」が、運動機能をつかさどる「大脳皮質運動野」の活動を活性化し、運動機能の回復を支えることを明らかにした。 恐怖体験の記憶形成の仕組み解明へ前進。PTSDの軽減に期待
恐怖体験の記憶形成の仕組み解明へ前進。PTSDの軽減に期待
ラットを使った実験により、恐怖記憶の形成には、ヘッブ仮説で示されたニューロン間のつながりが強化されるメカニズムだけでなく、注意を喚起する際に働く神経修飾物質の活性化も重要であることを示唆する結果が得られた。 バセドウ病の発症を予測するHLA遺伝子配列の同定に成功
バセドウ病の発症を予測するHLA遺伝子配列の同定に成功
理化学研究所は、HLA遺伝子の個人差をコンピュータ上で網羅的に解析する「HLA imputation法」を日本人に適用するためのデータベースを開発し、日本人のバセドウ病発症に関わるHLA遺伝子配列の同定に成功した。