規格だけでは安全性を保証できない:安全な医療機器設計と規格(1)(2/2 ページ)
安全な医療機器を設計するための指針として、さまざまな規格が策定されています。ですが、業界基準を満たす機器を設計するだけでは十分とはいえません。設計者は、リスクを特定し、それらを軽減する手法を採用する必要があります。
リスクの特定と安全対策の定義
医療機器を開発するタスクは、リスクを特定し、リスクが許容範囲であると自信を持って言えるような判断基準を確立することにある、と要約されます。
開発者は、潜在的危害の重大さと、危害が発生する確率を判断しなければなりません。許容範囲を超えるリスクを特定した場合、その後に開発者がするべきことは、リスクを軽減するための安全対策の定義です。
薬物注入ポンプを例に挙げて考えてみましょう。このポンプの主な機能は、流体を注入することです。注入機能に関連する潜在的危険性としては、流量ミス、誤った量の注入、予期せぬ注入開始または停止、超過圧力の上昇、空気の注入、そして逆流が挙げられます。設計者は、機器の故障時に、害を及ぼすことのないよう、開発時にこれらの要因を全て考慮に入れます。
幸いにも、安全性の指針となる規格が存在します。「IEC 60601-1-2-24」は薬物注入ポンプに特に適応した規格です。他にも、広く使用されている医療機器に適応する規格もあります。例えば「IEC 60601-2-16」は、透析機器に関連した規格です。ですが、先ほど説明したように、規格だけで機器の安全性を保証することはできません。設計者は、機器設計に必要な条件を判断するために、形式的なリスク分析を同時に実施しなければならないのです。
その点、「ISO 14971」は、機器のライフサイクルを通して医療機器の安全性を確固たるものにするために、製造業者がどのようにリスクマネジメントをすればよいかを説明した規格だといえます。こうした取り組みは、より高いレベルの規制や「ISO 13485」など別の品質規制で必須となっています。
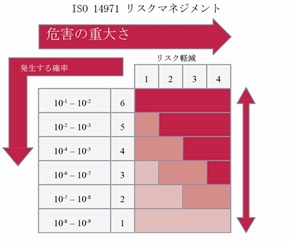
機器のリスクマネジメントについて規制している「ISO 14971」では、リスクの発生する確率と重要度に従って、リスクを分類する方法について詳しく説明しています。目標はリスクを軽減して、全てのリスクがこの図の一番下、主対角線の下まで下がるようにすることです
医療機器の安全性に関連する主な規制が、「IEC 60601-1 - 医療用電気機器 - 第一部:基本的な安全性と主要性能」です。国によっては、状況に応じてこの規制を除外し、他のバージョンの規制を採用する場合があります。例えば、欧州およびカナダ版の規制はIEC規格と同様のものですが、米国版の規制(ANSI/AAMI HA60601-1-11)では、養護施設が対象から除外されています。
また、この規格ではユーザビリティ要求に重点が置かれています。新しい基準が義務付けられている機器には、主に、酸素濃縮器、装着式の神経・筋肉刺激装置、ベッド、睡眠時無呼吸モニター、およびこれらの機器を自宅で使用するための充電装置などが挙げられます。
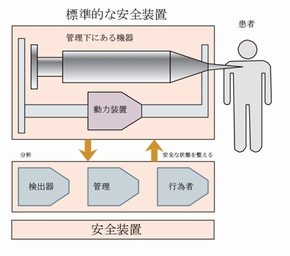
IEC 60601-1では原則の1つとして、「単一故障が発生した場合でも医療機器が安全でなければならない」、と定めています。単一故障は、安全装置上の故障として定義されています。したがって、安全な機器を設計する要素の1つとして、安全装置上で単一故障が発生した場合に、どのような危険が患者に及ぶかということ、そして単一故障が発生した場合でも、機器の安全性が保たれるような安全装置を実装することが挙げられるのです。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 ヘルスケア向けウェアラブル機器、“価値の創造”はまだこれから
ヘルスケア向けウェアラブル機器、“価値の創造”はまだこれから
ヘルスケア向けのウェアラブル機器は勢いに乗っているように見える。確かに、製品は大量に市場に投入され始めてはいるが、「本当に価値を提供できるサービスにはいきついていない」という見解もある。 ベッドの一部が分離して車いすに、パナソニックの介護向けベッド
ベッドの一部が分離して車いすに、パナソニックの介護向けベッド
パナソニックの離床アシストベッド「リショーネ」は、電動ケアベッドの一部が電動リクライニング車いすとして分離・変形する。介助する側/される側双方の負担を減らし、ベッドから車いすへスムーズに移乗できるという。 富士通、医療機器のワイヤレス化で患者負担や医療ミスを軽減
富士通、医療機器のワイヤレス化で患者負担や医療ミスを軽減
富士通は、IEEE 802.15.6規格に準拠した医療向け通信規格であるメディカルボディエリアネットワーク(mBAN)の試作無線機を開発。本装置を医療専用周波数帯(400MHz帯)に用いた国内初の実証実験を富士通クリニックにて実施した。