光照射とがん免疫の相乗効果によるがん治療法の開発:医療技術ニュース
名古屋大学は、さまざまな固形がんに幅広く発現している免疫チェックポイント分子PD-L1を標的として、がん免疫との相乗効果を示す近赤外光線免疫療法の応用開発に成功した。
名古屋大学は2021年11月2日、免疫チェックポイント分子PD-L1を標的として、がん免疫によって効果を高めた、近赤外光線免疫療法の応用開発に成功したと発表した。近赤外光線免疫療法による部分的な腫瘍壊死、免疫チェックポイント効果、がん微小環境の改変効果が相乗的に作用することで、抗腫瘍免疫を活性化して顕著な抗腫瘍効果を及ぼす。
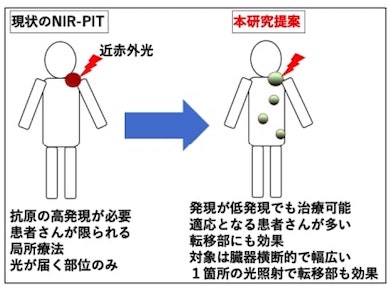
近赤外光線免疫療法は、がん細胞が発現したタンパク質を特異的に認識する抗体と光感受性物質IR700の複合体を体内に投与し、がん細胞上の標的タンパク質と結合した状態で近赤外光を照射することにより、がん細胞を破壊する。日本国内では、EGFRを高発現する再発既治療咽頭部がんに限って薬事承認を受けている。
今回の研究では、高発現ではないが、さまざまな固形がんで低度から中程度発現する免疫チェックポイント分子PD-L1を標的タンパク質として、細胞実験と動物実験で腫瘍への近赤外光線免疫療法の効果を検証した。
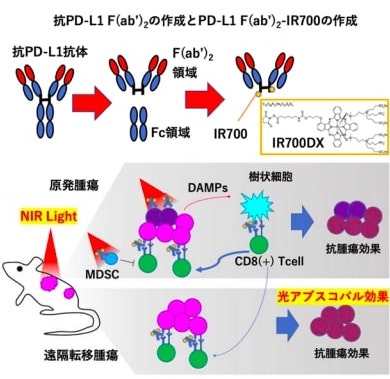
まず、マウスの抗PD-L1抗体のF(ab’)2領域とIR700の複合体PD-L1F(ab’)2を作成し、肺がんや大腸がんなどのマウス腫瘍細胞に対する近赤外光線免疫療法について検討した。その結果、それぞれの腫瘍細胞におけるPD-L1の発現が低いため、がん細胞の破壊効果は限定的な結果しか得られず、治療応用に適さないことが示唆された。
しかし、マウスの同種腫瘍移植モデルで検討したところ、細胞実験とは異なり、大幅な腫瘍の増大抑制効果と生存の延長が認められた。また、転移がんのモデルマウスでは、一カ所の腫瘍にのみ近赤外光線を照射したにもかかわらず、照射していない腫瘍でも腫瘍の増大抑制が得られた。
細胞実験と動物実験における治療効果の矛盾は、マウスでは免疫チェックポイント効果が働いて抗腫瘍免疫を担うCD8(+)T細胞やNK細胞が腫瘍内部で活性化していることや、腫瘍微小環境で骨髄由来免疫抑制細胞(MDSC)が減少していることから説明できる。近赤外光線免疫療法による部分的な腫瘍壊死とこれらの効果が相乗的に作用して、動物実験では腫瘍増大の抑制と生存の延長につながったと考えられる。
さらにマウスの血液解析からは、全身性に抗腫瘍免疫が増強していることが示唆された。そのことにより、光照射をしていない離れた転移巣にも効果を及ぼす、アブスコパル効果が得られたと考えられる。
今回の結果は、適切な特異的がん抗原が高発現していない患者でも、近赤外光線免疫療法の適応となり得ることを示唆する。がん特異抗原の高発現を応用した近赤外光線免疫療法の適応が受けられない患者への代替治療としての近赤外光線免疫療法の提案として、臨床現場の応用が期待できる。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 光電効果を用いて、効率よくがん細胞死を誘導する放射線治療法を開発
光電効果を用いて、効率よくがん細胞死を誘導する放射線治療法を開発
京都大学アイセムスは、がん細胞内に電子を発生させてDNAを効率よく切断し、細胞死を誘導する方法を開発した。アインシュタインが提唱した「光電効果」を利用するこの方法は、DNAに直接的に作用するため、放射線治療の効率向上が期待できる。 血液中の微量がん細胞を検出するマイクロフィルターデバイスを開発
血液中の微量がん細胞を検出するマイクロフィルターデバイスを開発
熊本大学とオジックテクノロジーズは、1mlの血液中に含まれる微量のがん細胞を簡便に検出できる、手のひらサイズのマイクロフィルターデバイスを開発した。検出能が非常に高く、約50億個の血球細胞を含む血液中から5個のがん細胞を捕捉する。 動物由来の成分を使わずにiPS細胞から大量の再生T細胞を培養
動物由来の成分を使わずにiPS細胞から大量の再生T細胞を培養
京都大学は、動物由来の成分を使用せずに、大量にT細胞を得る方法を開発した。この手法を用いてiPS細胞から作製したT細胞は、がん細胞を攻撃する能力を持っており、がん免疫療法に利用できる。 がん細胞が酸性環境下でも生存できるメカニズムを解明
がん細胞が酸性環境下でも生存できるメカニズムを解明
大阪大学は、がん組織内の酸性環境にがん細胞が自ら最適化する現象「acid addiction」を発見した。がん細胞は、リソソームを利用した仕組みにより、酸性環境下でも細胞内のプロトンを一定レベルに保って増殖できることが分かった。 体外からがん組織を深部まで観察できる粒子を開発
体外からがん組織を深部まで観察できる粒子を開発
山口大学、徳島大学、九州大学は共同で、蛍光生体イメージングにより、体外からがん組織を深部まで観察できる近赤外蛍光、有機シリカナノ粒子を開発した。 イメージングで、組織を切らずにその場でがん診断ができる技術を開発
イメージングで、組織を切らずにその場でがん診断ができる技術を開発
大阪大学は、生体イメージング技術を応用して、組織を切り取ったり染色したりしなくても、リアルタイムに3次元で可視化できる観察技術を共同開発した。患者への負担が少ない、迅速で定量的ながんの組織診断が可能になる。