トランプ政権下でも着々と進む米国のデジタルヘルス規制の枠組みづくり:海外医療技術トレンド(27)(3/3 ページ)
「医療機器」と「非医療機器」の双方に重なり合うデジタルヘルス。米国では、イノベーション促進に向けた規制の枠組みづくりが本格化している。
注目されるデジタルヘルスのソフトウェア事前認証プログラム
他方、FDAは、ソフトウェア事前認証プログラムについて、図3に示すような形のアプローチを示し、パイロットプログラムの開発を進めている。FDAとしては、ソフトウェアの設計、開発、バリデーションなど、客観的な基準に基づき、品質や組織の卓越性を示すデジタルヘルス開発企業をあらかじめ認証することによって、審査プロセスの簡素化と負荷軽減を図ろうとしている。
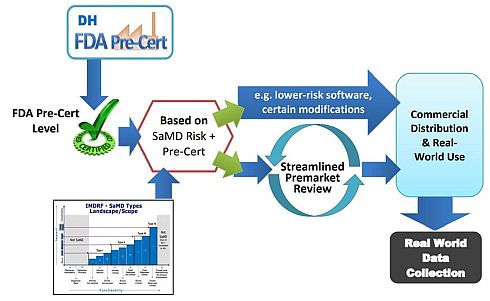
図3 米国FDAがソフトウェア事前認証プログラムを利用して新たに想定するアプローチの全体像(クリックで拡大) 出典:FDA「Digital Health Innovation Action Plan.」(2017年7月27日)
FDAは2017年8月1日、デジタルヘルスソフトウェア事前認証プログラムに関するWebセミナーを開催した(関連情報)。その中での注目されるのが、本連載第20回で取り上げた「ソフトウェア・アズ・ア・メディカル・デバイス(SaMD)」だ。
SaMDの臨床評価ガイドラインについては、国際医療機器規制当局フォーラム(IMDRF)のSaMDワーキング・グループが、欧州のアプローチに従い、スタンドアロンのソフトウェアを医療機器として規制するためのルールをとりまとめてきた歴史的経緯がある。これに対して米国は、複雑に相互接続されたオープンな環境下で稼働し、迅速かつ効率的に変更や修正を行うことが可能なソフトウェアを想定し、一歩踏み込んだ表現のガイドライン草案を策定してきた。
図4は、FDAが示したSaMD向けの事前認証プログラムの概要を示している。
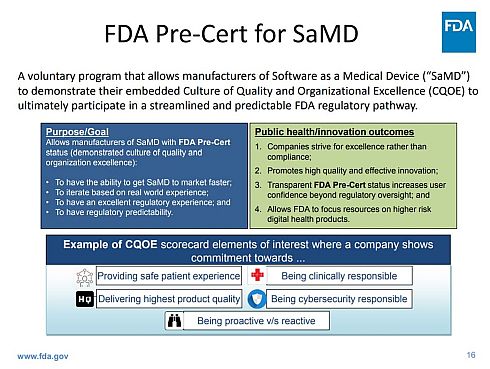
図4 米国FDAのソフトウェア・アズ・ア・メディカル・デバイス(SaMD)向け事前認証プログラム(クリックで拡大) 出典:FDA「Webinar - Digital Health Software Precertification (PreCert) Pilot Program.」(2017年8月1日)
FDAは、「品質や組織の卓越性の文化(COOE)」を示す要素の例として、以下のような項目を挙げている。
- 安全な患者経験を提供している
- 最高の製品品質を提供している
- 臨床的な責任を果たしている
- サイバーセキュリティの責任を果たしている
- プロアクティブ対リアクティブである
FDAは、これらの要素をベースに、組織的リソース、顧客、学習と成長、内部プロセスの観点から、重要業績評価指標(KPI)を集約したSaMDの評価基準フレームワークを構築する方向性を示している。パイロットプログラムの段階的なアプローチは、2017年9月〜2018年9月にかけて実施される予定だ。
なお、本連載第17回で医療機器規制のEU域内統一化に向けた動きを取り上げたが、2017年4月5日、欧州委員会が「医療機器指令」と「能動埋め込み型医療機器指令」を統合した「医療機器規則」と、「体外診断用医療機器規則」を採択し、前者は3年間の移行期間を経て2020年春より、後者は5年間の移行期間を経て2022年春より適用開始となる予定である(関連情報)。EUの新たな医療機器規制におけるデジタルヘルスの取扱いや、EU-米国間のハーモナイゼーションの観点からも、FDAの今後の動向が注目される。
筆者プロフィール
笹原英司(ささはら えいじ)(NPO法人ヘルスケアクラウド研究会・理事)
宮崎県出身。千葉大学大学院医学薬学府博士課程修了(医薬学博士)。デジタルマーケティング全般(B2B/B2C)および健康医療/介護福祉/ライフサイエンス業界のガバナンス/リスク/コンプライアンス関連調査研究/コンサルティング実績を有し、クラウドセキュリティアライアンス、在日米国商工会議所等でビッグデータのセキュリティに関する啓発活動を行っている。
Twitter:https://twitter.com/esasahara
LinkedIn:https://www.linkedin.com/in/esasahara
Facebook:https://www.facebook.com/esasahara
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
- 連載「海外医療技術トレンド」バックナンバー
 米国FDAが強化を求める医療機器のサイバーセキュリティ
米国FDAが強化を求める医療機器のサイバーセキュリティ
重要情報インフラの中でも、サイバー攻撃による脅威の拡大が顕在化している米国の医療界。医療のICTサプライチェーンを担う医療機器企業に対するセキュリティの要求事項も高度化している。 海外で進む医療ソフトウェア臨床評価の標準化
海外で進む医療ソフトウェア臨床評価の標準化
日本では、2014年11月の医薬品・医療機器等法施行により、スタンドアロン製品として承認申請や市販後対策の対象となった医療ソフトウェア。海外では、国境を越えた国際標準化への取り組みが着々と進んでいる。 医療機器関連でも域内統一化に向けたルール改正が集中するEU市場
医療機器関連でも域内統一化に向けたルール改正が集中するEU市場
2016年6月23日(欧州時間)に実施された国民投票で欧州連合(EU)離脱を選択した英国とは裏腹に、EU全体の医療機器関連市場では、域内ルールの統一化に向けた準備作業が同時並行で進んでいる。