連載
トランプ政権下でも着々と進む米国のデジタルヘルス規制の枠組みづくり:海外医療技術トレンド(27)(2/3 ページ)
「医療機器」と「非医療機器」の双方に重なり合うデジタルヘルス。米国では、イノベーション促進に向けた規制の枠組みづくりが本格化している。
デジタルヘルスに関わるガイドライン整備を進めるFDA
2017年1月に発足したトランプ政権下で、FDA長官に指名されたスコット・ゴットリーブ氏(関連情報)は、同年6月15日、モバイルアプリケーションから、フィットネストラッカー、臨床意思決定支援ソフトウェアに至るまで、デジタルヘルス分野のイノベーションを加速させる政策を打ち出す方針を表明した(関連情報)。これを受けて7月27日にCDRHは、「デジタルヘルス・イノベーション行動計画」を公表している(関連情報、PDFファイル)
この計画は、患者、消費者およびその他の医療の顧客を含む全ての米国人が、高品質で安全かつ効果的なデジタルヘルス製品に、最適なアクセスができるよう保証する方法を再考するための取り組みを提示することを目的としている。FDAは、図2に示すような統合的アプローチをベースとして、公衆衛生の保護と推進を継続しながら、デジタルヘルスのイノベーションを促進するために、以下のようなビジョンを掲げている。
- 21世紀医療法の医療ソフトウェア規定について明確性を提供するガイドラインの発行
- デジタルヘルス技術規定(FDAソフトウェア事前認証)向けの新たな手法を開発するために顧客と協働した、革新的なパイロット事前認証プログラムの立ち上げ
- CDRHのデジタルヘルス部門におけるFDAの人材層の厚さと専門性の構築
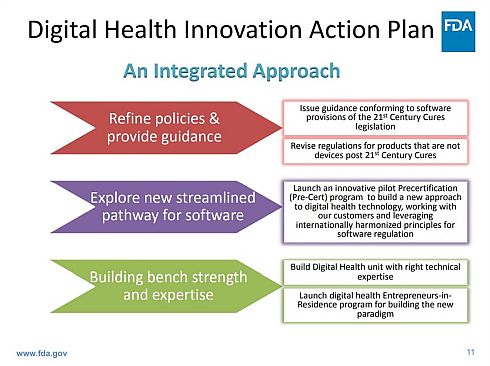
図2 米国FDA「デジタルヘルス・イノベーション行動計画」の統合的アプローチ(クリックで拡大) 出典:FDA「Webinar - Digital Health Software Precertification (PreCert) Pilot Program.」(2017年8月1日)
そして2017〜2018年にかけて、FDAは、以下のようなテーマに関わるガイドライン類の草案策定作業を進めている。
- (A)一般的な21世紀医療法導入ガイドライン
- (B)臨床意思決定支援ソフトウェア
- (C)多機能
- (D)既存デバイスのフトウェア変更のために、いつ501(k)を申請するかを決定するガイドラインの完成
- (E)国際医療機器規制当局フォーラム(IMDRF)のソフトウェア・アズ・ア・メディカルデバイス(SaMD)を臨床的に評価する手法の完成
Copyright © ITmedia, Inc. All Rights Reserved.